微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (13分)我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO? ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O="6Cu+" SO2
在③中被氧化与被还原元素原子的物质的量之比为??;若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为?。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式?。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费,?为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:

①试剂Y的名称?;物质X最好是?(填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5mol·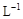 ,?则加入Cl2气和物质X使溶液的pH在??范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、? KSP[Cu(OH)2]=2.0×10—20?、?lg5=0.7)
,?则加入Cl2气和物质X使溶液的pH在??范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38、? KSP[Cu(OH)2]=2.0×10—20?、?lg5=0.7)
参考答案:(13分)
(1)1﹕6 (2分), 7.5mol(3分,没单位扣1分)。
(2)Cu2O+2H+=Cu+Cu2++H2O (2分,没配平扣1分,化学式错0分)
(3)①盐酸或氯化氢(1分);CuO (2分)。② 3.0—4.3(3分)
本题解析:(1) Cu2S+ 2Cu2O="6Cu+" SO2中,被氧化的元素即化合价升高的元素是S元素,被还原的元素即化合价降低的元素是Cu元素,由方程式可知,③中被氧化与被还原元素原子的物质的量之比为1:6;
由①得6CuFeS2~12O2~3Cu2S; 由②得 2Cu2S ~ 3O2~2Cu2O, 由③Cu2S~ 2Cu2O~6Cu,所以最终得关系式6CuFeS2~15O2~6Cu,若由3mol CuFeS2生成3molCu,理论上消耗O2的物质的量为7.5mol;
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,根据氧化还原反应理论,蓝色溶液为硫酸铜溶液,红色固体为单质铜,离子方程式为Cu2O+2H+=Cu+Cu2++H2O;
(3)①由氢氧化铁生成氯化铁,需要试剂Y是稀盐酸或氯化氢;加入X的目的是调节溶液pH,使铁离子沉淀,所以为了不引入新的杂质,X最好选择CuO;
②加入氯气后铜离子的浓度仍是0.5mol/L,铁离子的浓度为1.0mol/L,根据所给沉淀的溶度积计算氢氧化铁完全沉淀时的c(OH-)3=1.0×10—38 /1.0×10—5mol·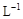 , 则c(OH-)=1.0×10—11mol·
, 则c(OH-)=1.0×10—11mol·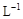 , pH=3;当铜离子开始沉淀时,c(OH-)2=2.0×10—20 /0.5=4.0×10—20mol·
, pH=3;当铜离子开始沉淀时,c(OH-)2=2.0×10—20 /0.5=4.0×10—20mol·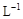 ,c(OH-)=2.0×10—10mol·
,c(OH-)=2.0×10—10mol·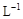 ,pH=4.3,所以铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀时溶液对pH的范围是3.0—4.3。
,pH=4.3,所以铁元素完全转化为Fe(OH)3,而CuCl2不产生沉淀时溶液对pH的范围是3.0—4.3。
本题难度:一般
2、选择题 对于反应3Cl2+6NaOH 5NaCl+NaClO3+3H2O,以下叙述正确的是(?)
5NaCl+NaClO3+3H2O,以下叙述正确的是(?)
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
参考答案:C
本题解析:略
本题难度:简单
3、选择题 已知NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是(?)
A.NH4CuSO3中硫元素被氧化了
B.刺激性气味的气体是二氧化硫或氨气
C.该反应中NH4CuSO3既是氧化剂又是还原剂
D.该反应中硫酸既表现为酸性又表现氧化性
参考答案:C
本题解析:A项:溶液中的离子都不足以氧化亚硫酸根,S在反应前后都是+4价,故错。B项:氨气在酸性环境中更易生成铵根而保留在溶液中。D项:硫酸浓度不够,并不能体现出明显的氧化性。这里只是发挥酸化的作用。故选C。
点评:本题考查氧化还原反应,难度较大,注意从反应现象判断生成物,结合化合价的变化决定氧化剂和还原剂。
本题难度:简单
4、填空题 Fe2O3高温下通CO气体,写出化学方程式:? ,? 是氧化剂,? 元素被还原,? 是氧化产物,电子转移总数为? 。
参考答案:Fe2O3+3CO 2Fe+3CO2 ;? Fe2O3;Fe;CO2; 12
2Fe+3CO2 ;? Fe2O3;Fe;CO2; 12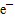
本题解析:
本题难度:一般
5、选择题 将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。下列推测肯定不正确的是
[? ]
A.①中红色褪去的原因是KMnO4将SCN-氧化
B.②中红色褪去的原因是SO2将Fe3+还原为Fe2+
C.②中红色褪去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化为(SCN)2
参考答案:C
本题解析:
本题难度:一般