微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应不能发生的是( )
A.KCl+NaOH=NaCl+KOH
B.AgNO3+NaCl=AgCl↓+NaNO3
C.Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
D.CaCO3+H2O+CO2=Ca(HCO3)2
参考答案:A、因KCl溶液与NaOH溶液相互交换成分不生成水、气体、沉淀,则物质不能发生化学反应,符合题意,故A正确;
B、因AgNO3溶液与NaCl溶液相互交换成分能生成氯化银沉淀,则能反应,不符合题意,故B错误;
C、碳酸钠溶液与氢氧化钙溶液相互交换成分能生成碳酸钡沉淀,则能反应,不符合题意,故C错误;
D、碳酸盐中继续通二氧化碳会转化为可溶的碳酸氢钠,故能反应,不符和题意,故D错误.
故选A.
本题解析:
本题难度:一般
2、选择题 将稀硫酸和氯化镁分别滴加到下列溶液中,均有白色沉淀生成的是
[? ]
A、BaCl2
B、Ba(OH)2
C、Na2CO3
D、Fe2(SO4)3
参考答案:B
本题解析:
本题难度:一般
3、填空题 现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH
已知:CO2+3H2O+2AlO2-==2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是_____________(填编号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是________________(填编号)
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是______________(填编号)
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式______________________。
参考答案:(1)④②①③⑤
(2)⑤
(3)①②
(4)HCO3-+AlO2-+H2O==Al(OH)3↓+CO32-
本题解析:
本题难度:一般
4、填空题 .(12分) 现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产
生下列离子(各种离子不重复)。
阳离子
| H+、Na+、A13+、Ag+、Ba2+
|
阴离子
| OH-、C1-、CO32-、NO3-、SO42-
|
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性;常温下,0.1 mol/L
B溶液的pH大于13,0.1 mol/L C溶液的pH等于1
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有
气体产生;(沉淀包括难溶物和微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)写出A、B、C、D、E的化学式:A、?B、?
C、?D、?E?
(2)写出A、E溶液反应的离子方程式:
?。
(3)写出B溶液与C溶液恰好完全反应的离子方程式:
?_____?。
(4)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由小到大的顺序为(带两个单位电荷的离子不参与比较):__________________________________。
参考答案:(1)A、Na2CO3?B、Ba(OH)2?C、HCl D、 AgNO3?E、 Al2(SO4)3(5分)
(2)2A13++3 CO32-+3 H2O =2Al(OH)3↓+3CO2↑(2分)
(3)OH-+H+=H2O(2分)
(4)c(H+)<c(OH-)<c(HCO3-)<c(C1-)<c(Na+)(3分)
本题解析:(1)阴阳离子两两组合,其中必需的组合为AgNO3、Na2CO3;A、B两溶液呈碱性,A、B可能为Na2CO3、Ba(OH)2、Na OH,常温下,0.1 mol/L B溶液的pH大于13,则B为Ba(OH)2;C、D、E溶液呈酸性,且0.1 mol/L C溶液的pH等于1,则C为一元强酸HCl;A溶液与C溶液反应只有气体产生,A溶液含有CO32-,且必需为Na2CO3;A溶液与E溶液反应既有气体又有沉淀产生,E溶液含有A13+,此时阴离子只有SO42-,E为Al2(SO4)3;D为AgNO3?。
(4)将HCl溶液逐滴加入等体积、等物质量的浓度的Na2CO3溶液中,恰好完全反应生成NaHCO3和NaCl,假设NaHCO3和NaCl均为1,则含2个Na+,1个C1-,HCO3-水解,HCO3-的量要略小于1,溶液显碱性c(H+)<c(OH-),综合得:c(H+)<c(OH-)<c(HCO3-)<c(C1-)<c(Na+)。
本题难度:一般
5、选择题 向含有NaOH、Ba(OH)2、KAlO2均为1mol的混合溶液中慢慢通入足量的CO2,得到的沉淀和通入CO2的关系正确的是(?)
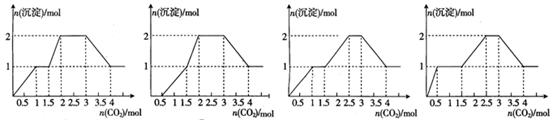
A? B? C? D
参考答案:A
本题解析:溶液中各离子的物质的量分别为:OH—:3mol;AlO2—:1 mol;Ba2+:1mol;
发生的离子反应依次为:
(1)0 mol<n(CO2)<1mol:CO2+2OH-=CO32-+H2O? CO32-+Ba2+=BaCO3↓
(2)1mol<n(CO2)<1.5mol:CO2+2OH-=CO32-+H2O
(3)1.5mol<n(CO2)<2mol:CO2+2AlO2-+3H2O=2Al(OH)3+CO32-
(4)2mol<n(CO2)<3mol:CO32-+H2O +CO2=2HCO3-
(5)3mol<n(CO2)<4mol:BaCO3+H2O +CO2= Ba2++2HCO3-,故选A
本题难度:一般