|
|
|
高考化学知识点整理《化学反应进行的方向》考点预测(2017年强化版)(六)
2017-08-08 03:42:31
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有可逆反应A(g)+B(g)  2C(g),在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。填写下列空白: 2C(g),在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示。填写下列空白:
⑴反应在 温度下达到平衡。 ⑵正反应为 热反应(填“放”或“吸”)。 ⑶由T3向T4变化时,v正 v逆(填“>”、“<”或“=”)。
参考答案:⑴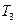 ⑵放 ⑶ < ⑵放 ⑶ <
本题解析:略
本题难度:一般
2、选择题 在密闭容器中进行如下反应:A(s)+2B(g) 3C(g)?△H<0,达平衡后,改变下列反应条件,相关叙述正确的是 3C(g)?△H<0,达平衡后,改变下列反应条件,相关叙述正确的是
A.加入少量A,正反应速率增大,平衡向正反应方向移动
B.降低温度,正反应速率加大,逆反应速率变小,平衡向正反应方向移动
C.增大压强,正反应速率和逆反应速率都增大,平衡向逆反应方向移动
D.增大压强,能加快反应速率的主要原因是增大了活化分子的百分数
参考答案:C
本题解析:略
本题难度:简单
3、选择题 下列关于化学反应进行的方向说法正确的是
A.放热反应都能自发进行,吸热反应都不能自发进行
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.能自发进行的反应一定能实际发生
D.常温下,反应C(s)+CO2(g) ="==" 2CO(g)不能自发进行,则该反应的ΔH>0
|
参考答案:D
本题解析:
试题解析:放热反应不一定能自发进行,比如说铁的燃烧虽然是放热反应,但是需要提供瞬间高温才能引发,硫酸铵结晶水合物和氢氧化钡的反应在常温下就能进行,但属于吸热反应,故A错误;若△H<0,△S>0,则一定自发,若△H>0,△S<0,则一定不能自发,若△H<0,△S<0或△H>0,△S>0,反应能否自发,和温度有关,故B错误;反应的自发性是反应能否进行的可能性的推断,并不是实际一定能发生,即能自发进行的反应实际可能没有发生反应,故C错误;该反应的△S>0,若△H<0,则一定自发,现常温下不自发,说明△H>0,故D正确.
考点:化学反应进行的方向
本题难度:一般
4、选择题 下列有关说法正确的是
A.SO2(g)+H2O(g)→H2SO3(l),该过程熵值增大
B.SO2(g)→S(s)+O2(g)△H>0,△S<0该反应能自发进行
C.SO2(g)+2H2S(g)=3S(s)+2H2O(l) ,常温常压下一定能自发进行
D.某温度下SO2(g)+1/2O2(g)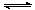 SO3(g),K1=20, SO3(g),K1=20,
|
则相同温度下2SO3(g)
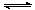
2SO2(g)+O2(g)的平衡常数为1/400
参考答案:
CD
本题解析:
本题考查化学平衡的有关知识。A选项混乱度减小,熵值减小,错误;根据△G=△H-T△S可知,△G恒大于0,所以该反应不能自发,B选项错误;该反应为氧化还原反应,混乱度减小,在常温下可以迅速反应,C选项正确;K1= =20,则 = = ,D选项正确。
本题难度:一般
5、选择题 对于化学反应能否自发进行,下列说法中错误的是( )
A.若ΔH<0,ΔS>0,任何温度下都能自发进行
B.若ΔH>0,ΔS<0,任何温度下都不能自发进行
C.若ΔH>0,ΔS>0,低温时可自发进行
D.若ΔH<0,ΔS<0,低温时可自发进行
参考答案:C
本题解析:ΔG<0的反应为自发反应,若ΔH>0,ΔS>0,为保证ΔG=ΔH-TΔS<0,只有在高温下才能是自发反应。
本题难度:一般
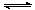 2SO2(g)+O2(g)的平衡常数为1/400
2SO2(g)+O2(g)的平衡常数为1/400