微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA表示阿伏加德罗常数,下列说法正确的是
①?6.8g熔融的KHSO4中含有0.1Na个阳离子。
②?1L1mol/L的盐酸溶液中,含HCl分子数为1Na。
③?常温常压下,11.2L的CH4中含有的H数为2Na。
④?0.1molNa2O2与水完全反应,转移0.2NA的电子。
⑤?62gNa2O溶于水中,所得溶液中有1Na个O2-
⑥?1L1mol/L的醋酸溶液中离子总数为2Na?
⑦?标准状况下,22.4L氩气含有原子数为2Na。
⑧?常温常压下,32gO2、O3的混合物含有2Na个氧原子。
⑨?1L1mol/L的酒精溶液,含有1Na个分子。
⑩1molFe和足量的盐酸反应,失去3Na个电子。
A.①②⑤⑦⑧
B.②④⑥⑧⑩
C.⑧⑩
D.⑧
参考答案:D
本题解析:①错,在熔融条件下,它的电离方式是可KHSO4=K+ + HSO4-,阳离子只有K+,为0.05NA个。
②错,HCl在溶液中全部电离,没有HCl分子存在。
③错,常温常压下,11.2L的CH4中,CH4物质的量不等于0.5mol,
④错,过氧化钠和水反应是歧化反应,一半的得电子,一半失电子,转移0.1NA的电子
⑤错,O2-在溶液中不存在,
⑥错,醋酸是弱电解质,不可能完全电离,离子总数小于2Na
⑦错,氩是单原子分子,1mol氩气含有原子数为1Na
⑧正确,32gO2、O3的混合物,可以理解是32g氧原子,n(O)=32g/16g/mol=2mol
N(O)=2NA,质量和物质的量关系,与温度压强没有关系。常温常压下容易产生误导
⑨错,1L1mol/L的酒精溶液,应该包括水分子和酒精分子,
⑩错,Fe和盐酸反应生成Fe2+,1molFe和足量的盐酸反应,失去2Na个电子
本题难度:一般
2、填空题 在0.3 molNH3中约含NH3的分子数是 个原子数是 个这些NH3中所含的分子数与 mol的水分子数相等,与 mol的硫酸分子数相等。
参考答案: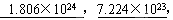 0.3,0.3
0.3,0.3
本题解析:略
本题难度:一般
3、选择题 今有相同体积的两份植物营养液,其配方如
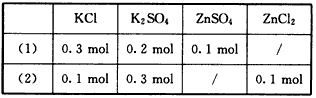
两份营养液中各离子浓度
[? ]
A.完全不同
B.仅c(K+)相同
C.仅c(Cl-)相同
D.完全相同
参考答案:D
本题解析:
本题难度:简单
4、填空题 钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
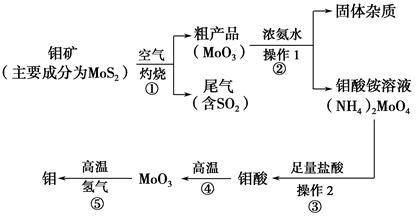
(1)写出反应①的化学方程式: 。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂 。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为 。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
参考答案:(1)2MoS2+7O2 2MoO3+4SO2
2MoO3+4SO2
(2)H2SO4、Na2SO3[或Na2SO4、(NH4)2SO4等]
(3)烧杯、漏斗、玻璃棒
(4)Na2MoO4
(5)4.11a g
本题解析:(1)二硫化钼与氧气在高温下反应生成三氧化钼和二氧化硫。
(2)二氧化硫可收集再利用,制备硫酸和盐类等。
(3)操作1和操作2都是分离固体与液体混合物,都是过滤操作。
(4)钼酸是二元酸,可直接写出钼酸钠。
(5)根据反应方程式知,1 mol甲烷完全反应生成4 mol还原性气体,而:3CO+MoO3 Mo+3CO2,3H2+MoO3
Mo+3CO2,3H2+MoO3 Mo+3H2O,3 mol还原性气体理论上生成1 mol钼。n(CH4)=
Mo+3H2O,3 mol还原性气体理论上生成1 mol钼。n(CH4)= ×80%,n(H2+CO)=
×80%,n(H2+CO)=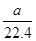 ×80%×90%×4 mol=
×80%×90%×4 mol=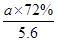 ,n(Mo)=
,n(Mo)=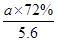 ×
×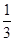 mol=
mol=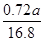 mol,m(Mo)=
mol,m(Mo)=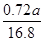 mol×96 g·mol-1≈4.11a g。
mol×96 g·mol-1≈4.11a g。
本题难度:一般
5、填空题 (每空2分,共4分).相同条件下,同质量的SO2和SO3气体,体积比为?,密度比为?
参考答案:5:4、? 4:5
本题解析:在相同条件下,体积之比是相应的物质的量之比,所以同质量的SO2和SO3气体,体积比为80︰64=5:4;相同条件下,气体的密度之比是相应的摩尔质量之比的反比,因此密度之比是64︰80=4:5。
本题难度:一般