|
|
|
高中化学知识点讲解《水的电离平衡》答题技巧(2017年最新版)(七)
2017-08-08 03:46:54
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为 ( )
A.c (CH3COO-)="c" (Na+)
B.c (OH-)>c (H+)
C.c (CH3COOH)>c (CH3COO-)
D.c (CH3COOH)+c (CH3COO-)=0.01mol/L
|
2、选择题 一定温度下,向300 mL l mol/L的NaOH溶液中通入bmol CO2,下列说法正确的是
A.通入CO2过程中溶液中的Kw减小
B.b=0.3与b=0.15时,所得溶液中的微粒种类不相同
C.当b=0.2时,所得溶液中部分离子浓度关系为:c(HCO3一)>c(CO32-)>c(OH-)>c(H+)
D.当恰好生成NaHCO3时,溶液中存在:c(Na+ )+c(H十)=c(HCO3-)+c(OH一)
|
3、填空题 (6分)水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
4、填空题 (10分)(1)某温度(t℃)时,水的Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b ;
②若所得混合液的pH=2,则a∶b ;
(2)将等体积的氨水与盐酸溶液混和后,若混和溶液中c(NH4+)=c(Cl-),则溶液中的pH值__ _7,混和前c(NH3·H2O)_ _ c(HCl),氨水中c(OH-) _盐酸中c(H+)。(填>、<或=,下同)
5、实验题 (14分)I.如下图所示,50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在装置中进行中
和反应。通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
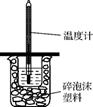
(1)图中装置缺少的仪器是 。
(2)下列说法不正确的是 (填序号)。
A.若用50mL0.55mol·L-1Ba(OH)2溶液代替NaOH溶液进行实验,测得的中和热相同
B.若用50mL0.50mol·L-1醋酸溶液代替盐酸进行实验,测得的中和热相同
C.若分别用等浓度的硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行实验,测得的中和热相同
D.NaOH溶液稍过量的原因是让盐酸完全反应
II.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)实验中眼睛注视_______________,直至滴定终点。判断到达终点的现象是__________________。
(3)若三次实验所用KOH溶液体积分别为14.98 mL,16.80 mL,15.02 mL则c(HCl)= 。
(4)下列操作中,可能造成测定结果偏高的是 。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管中液面刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
