微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13,Ksp(AgI)=8.3×10-17。下列说法正确的是
[? ]
A.25℃时的任何溶液中,氯化银的溶解度均大于溴化银
B.往氯化银的悬浊液中加硝酸银,c(Cl-)、c(Ag+)均减小
C.25℃时1.435g氯化银加入1L水中,所得溶液中c(Cl-)约等于0.01mol/L
D.往c(Cl-)=c(I-)=0.01mol/L的钠盐溶液中加硝酸银固体,当氯化银开始沉淀时,碘离子已经全部沉淀了
2、选择题 已知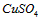 溶液分别与
溶液分别与 溶液.
溶液. 溶液的反应情况如下
溶液的反应情况如下
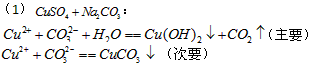

则下列对物质溶解度的比较正确的是
[? ]
A.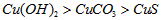
B.
C.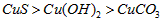
D.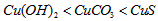
3、填空题 结合下表回答下列问题:
物?质
| Fe(OH)2
| Cu(OH)2
| Fe(OH)3
|
溶度积/25℃
| 8.0×10-16
| 2.2×10-20
| 4.0×10-38
|
完全沉淀时的pH范围
| ≥9.6
| ≥6.4
| 3~4
|
(1)CuCl2溶液中含有少量的FeCl2和FeCl3,为得到纯净的CuCl2?2H2O晶体,可先加入适量氯水,发生的离子反应为:_________________________________;再加入_______________________,调至pH=4,此时溶液中的c(Fe3+)=__________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2?2H2O晶体。
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,由CuCl2?2H2O晶体得到纯的无水CuCl2的合理方法是___________________________________________。
4、选择题 在溶液中有浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39; Ksp[Cr(OH)3] =7.0×10-31 Ksp[Zn(OH)2] =1.0×10-17; Ksp[Mg(OH)2] =1.8×10-11当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
[? ]
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
5、选择题 向5mL?0.2mol/L的盐酸中加入5mL0.18mol/L?AgNO3溶液生成沉淀,则生成沉淀后溶液中Ag+的物质的量浓度为(已知?Ksp(AgCl)=1.8×10-10)( )
A.不存在
B.1.8×10-6mol/L
C.1.8×10-7mol/L
D.1.8×10-8mol/L