微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)已知硝酸铜溶液呈蓝色。但在铜与浓硝酸、稀硝酸反应的实验中,同学们发现,除了生成的气体颜色不相同外,最终溶液的颜色也不相同:前者呈绿色,而后者呈蓝色。
甲、乙二位同学为此进行了实验探究。
甲:在I、II两支试管中分别加入等体积的浓HNO3和稀HNO3,再向两支试管中分别投入等质量的铜片,充分反应后铜均无剩余。结果:I中溶液呈绿色,II中溶液呈蓝色。
乙:分别取I中的绿色溶液于两支试管Ⅲ、IV中,对试管Ⅲ进行多次振荡、静置,最终溶液颜色由绿色转变为深蓝色;向试管IV中缓缓加水并不停振荡,观察到溶液由绿色变为深蓝色,最后变为淡蓝色。
请回答下列问题:
(1)分别写出Cu与浓HNO3、稀HNO3反应的化学方程式:__________、__________。
(2)甲的实验_______(“能”或“不能”)说明溶液呈现不同的颜色与其物质的量浓度无关,这是因为充分反应后,I、II两试管中Cu(NO3)2溶液的物质的量浓度_______(填“相等”或“不相等”)。
(3)请你根据乙的实验,推测Cu与浓HNO3反应后溶液呈绿色的原因是________
_______________________________________________________________。
(4)请设计一个方案,验证你所得到的上述结论:____________________________。
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(2分)
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(2分)
(2)能(2分)?相等(2分)
(3)反应产生的NO2部分溶解于浓硝酸中呈黄色,与蓝色的硝酸铜溶液混合而使溶液呈绿色(3分)
(4)方案一:取Cu与浓HNO3反应后的绿色溶液,向其中通入足量的空气(或氧气),溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色。
方案二:取Cu与浓HNO3反应后的绿色溶液,加热,溶液颜色由绿色逐渐变为蓝绿色,最终变为蓝色(可任选其中一个作答)。(4分)
本题解析:略
本题难度:简单
2、选择题 有关硝酸化学性质的叙述不正确的是(?)
A.浓硝酸和稀硝酸都具有氧化性
B.铜与硝酸的反应属于置换反应
C.金属与硝酸的反应一般不产生氢气
D.可用铁或铝制品盛装浓硝酸
参考答案:B
本题解析:铜与硝酸的反应不是生成一种单质和一种化合物,故不可能属于置换反应。金属与硝酸反应是+5价的氮被还原,不产生氢气。铁和铝常温下被浓硝酸钝化。
本题难度:简单
3、选择题 磷化氢的分子式为PH3,又称为膦,是一种无色有类似大蒜气味的气体,剧毒,膦在空气中的着火点是150℃,下列叙述中正确的是(?)
A.膦分子呈三角锥形,其中P-H键的键长要小于氨分子中N-H键的键长
B.膦的水溶液呈碱性,但其pH要比同浓度氨水的pH大
C.膦是一种还原性的气体,其还原性比氨气的还原性要强
D.化合物PH4I是一种很稳定的晶体,在受热时不分解
参考答案:(C)
本题解析:膦是一种没有学过的化合物,题给信息并不多,要判断题设的4个选项,一定要以同族的同类化合物——氨作为对比物,充分进行深入的对比分析,发挥思维创造性。
对选项(A)的判断比较容易,已知氨分子是三角锥形,当然膦分子也是三角锥形。从同主族元素的关系来看,在微观上磷元素的原子半径应比氮元素原子半径大,因而P-H键的键长一定大于N-H键的键长,则(A)不正确。
从氨水呈弱碱性来看,膦的水溶液也应呈弱碱性。同主族非金属元素的气态氢化物的水溶液,随着元素核电荷数的递增,酸性逐渐增强,反之,碱性应逐渐减弱,故同浓度时,氨水的碱性强于膦,则(B)不正确。
氨具有还原性,同样,膦也有,且同主族元素从上到下元素的还原性逐渐增强,故膦的还原性强于氨,NH3在O2中可以点燃,而膦的着火点只有150℃,说明PH3比NH3还原性强,则(C)正确。
我们熟悉的NH4Cl受热易分解,因此,PH4I受热也易分解,(D)不正确。
本题难度:简单
4、选择题 1.92 g Cu跟适量的浓硝酸反应,Cu全部反应后,共收集到气体1.12 L(标准状况),反应消耗的HNO3的物质的量可能是(?)
A.0.12 mol
B.0.11 mol
C.0.09 mol
D.0.08 mol
参考答案:B
本题解析:在与Cu的反应中,HNO3分为两部分:一部分作氧化剂,被还原为NO或NO2,根据HNO3(作氧化剂)→NO、HNO3→(作氧化剂)NO2,可计算出作氧化剂的HNO3为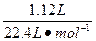 ="0.05" mol;另一部分作酸,根据2HNO3→Cu(NO3)2,可计算出作酸的HNO3为
="0.05" mol;另一部分作酸,根据2HNO3→Cu(NO3)2,可计算出作酸的HNO3为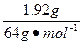 ×2="0.06" mol。两部分HNO3共0.05 mol+0.06 mol="0.11" mol。
×2="0.06" mol。两部分HNO3共0.05 mol+0.06 mol="0.11" mol。
本题难度:简单
5、选择题 M(NO3)2受热分解的化学反应方程式为:2 M(NO3)2 ="=" 2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,那么M的摩尔质量是
A.65 g·mol-1
B.64g·mol-1
C.40 g·mol-1
D.24 g·mol-1
参考答案:D
本题解析:由方程式2 M(NO3)2 ="=" 2MO+4NO2↑+O2↑可知,2mol M(NO3)2 完全分解生成5mol气体,因加热29.6g M(NO3)2使其完全分解,在标准状况下收集11.2L的气体,所以可得M的摩尔质量是24 g·mol-1
本题难度:一般