微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号.请参照元素A~J在周期表中的位置,回答下列问题:
纵行
横行 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18
1
A
2
B
C
D
3
F
G
H
E
I
J
|
(1)上表中元素的最高价氧化物对应的水化物中碱性最强的是______(用化学式表示)、酸性最强的是______(用化学式表示);
(2)J的原子结构示意图为______;C在周期表的第______族;
(3)最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是______;
(4)D、E、F、G四种元素简单离子的离子半径由大到小的顺序是(用化学符号表示)______>______>______>______;
(5)写出化学方程式:①用电解法冶炼G______;
②都含有A、F、D、E四种元素的两种盐溶液相互反应______.
(6)请设计一个简单的实验证明C元素的非金属性比B强(只写化学方程式)______.
(7)G元素既表现金属性又有一定的非金属性,请用AlCl3溶液、NaOH溶液设计实验证明(要求写出步骤、现象、离子反应程式)______;______.
参考答案:表格中A为H,B为C,C为N,D为O,E为S,F为Na,G为Al,H为Si,I为Cl,J为Ar.
(1)在元素周期表中同主族从上到下,金属性逐渐增强,非金属性逐渐减弱,同一周期从左到右金属性逐渐减弱,非金属性逐渐增强,故最左下角的F元素Na金属性最强,对应的最高价氧化物对应水化物的碱性最强故为NaOH,非金属性最强的为I,为Cl,其最高价氧化物对应的水化物酸性最强,故酸性最强的为HClO4
故答案为:NaOH; HClO4 ;
(2)J为Ar,为18号元素,故其原子结构示意图为
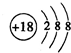
,C为N,位于元素周期表的第二周期,第VA族;
故答案为:

; VA;
(3)N元素的氢化物为氨气,是一种碱性气体,最高价氧化物对应水化物为强酸,两者可发生中和反应,故此元素为N;?
故答案为:N;?
(4)D为O,E为S,F为Na,G为Al,对应的离子为 02-,S2-,Na+,Al3+,其中S2-为18电子构型,其余均为10电子,故S2-半径最大,当核外电子数相同时,离子的核电荷数越大,离子半径越小,核电荷数铝>钠>氧,
故离子半径S2->02->Na+>Al3+;
故答案为:S2->02->Na+>Al3+;
(5)G为Al,电解精炼铝的化学方程式为2Al2O3?电解?.?4Al+302;A为H,D为O,E为S,F为Na,都含有A、F、D、E四种元素的两种盐溶液,可以相互反应,符合条件的是亚硫酸氢钠和硫酸氢钠,亚硫酸氢钠为一种酸式盐,硫酸氢钠可以完全电离出氢离子,可以反应生成二氧化硫和水,反应方程式如下:
NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O
故答案为:2Al2O3?电解?.?4Al+302 NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O;?
(6)B为C,C为N,证明其非金属性强弱可以有很多方法,如对应氢化物的稳定性,最高价氧化物对应水化物的酸性等,其中酸性比较可以用硝酸与碳酸钠反应生成硝酸钠和二氧化碳、水,二氧化碳和水即为碳酸,强酸制取弱酸,故硝酸酸性强,反应方程式为2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
故答案为:2HNO3+Na2CO3=2NaNO3+H2O+CO2↑
(7)G为Al元素既表现金属性又有一定的非金属性,向AlCl3溶液中逐渐滴加NaOH溶液,有白色沉淀析出,说明铝元素具有金属性,然后又逐渐溶解说明其具有非金属性,反应的方程式可以分段书写为:
Al3++3OH-=Al(OH)3↓; Al(OH)3+OH-=[Al(OH)4]-
故答案为:向AlCl3溶液中逐渐滴加NaOH溶液,有白色沉淀析出,然后又逐渐溶解;Al3++3OH-=Al(OH)3↓;
Al(OH)3+OH-=[Al(OH)4]-
本题解析:
本题难度:一般
2、选择题 下列各物质中,按熔点由高到低的顺序排列的是
A.H2Te > H2Se > H2S > H2O
B.KCl>NaCl>LiCl>HCl
C.Sr>Ba>Ca>Be
D.金刚石>SiC>晶体硅
参考答案:D
本题解析:试题分析:水分子间存在氢键,所以水的熔沸点高,A不正确,应该是H2O> H2Te > H2Se > H2S;对于离子晶体,形成离子键的离子半径越小,所带电荷数越多,离子键越牢固,离子晶体的熔点越高,B不正确,应该是LiCl>NaCl>KCl > HCl;第ⅡA族元素单质的熔点自上而下是逐渐减小的,则选项C不正确。D中都是原子晶体,原子半径越小,共价键越牢固,原子晶体的熔点越高,D正确,答案选D。
考点:考查物质熔点大小的判断
点评:该题是高考中的常见考点,属于基础性试题的考查,侧重考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力。该题的关键是明确晶体的类型,以及影响熔点大小的因素,然后灵活运用即可。
本题难度:简单
3、选择题 短周期元素A、B、C在周期表中所处的位置如表所示.A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次外层电子数的2倍.则下列说法正确的是( )
A.元素D形成的气态氢化物的分子构型一定是正四面体
B.A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
C.在DB2、BC6、DC4的分子中,每个原子都满足8电子稳定结构
D.四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高
参考答案:由短周期元素A、B、C在周期表中所处的位置关系可知,A、C处于第二周期、B处于第三周期,A、B、C三种元素原子的质子数之和为32,令A的原子序数为x,则B的原子序数为x+8,C的原子序数为x+2,则:x+x+9+x+2=32,解得x=7,故A为氮元素、B为硫元素、C为氟元素;D元素原子的最外层电子数为次外层电子数的2倍,则D元素原子有2个电子层,最外层电子数为4,故D为碳元素,
A.碳元素形成的乙烯为平面结构、乙炔为直线结构,故A错误;
B.氨气与硝酸反应生成硝酸铵,硫化氢被浓硫酸氧化生成二氧化硫与水,二者反应类型不同,故B错误;
C.在CO2、CF4的分子中每个原子都满足8电子稳定结构,SF6分子中S原子周围有12个电子,故C错误;
D.C为氟元素,F元素非金属性最强,氢化物最稳定,故D正确;
故选D.
本题解析:
本题难度:简单
4、选择题 已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是
A.铍的原子半径小于硼的原子半径
B.铍与等浓度盐酸的反应比镁剧烈
C.氢氧化铍的碱性比氢氧化钙弱
D.单质铍能与冷水反应产生氢气
参考答案:C
本题解析:同一周期,从左到右,原子半径逐渐减小,所以铍的原子半径大于硼的原子半径;同一主族,从上到下,金属性逐渐增强,即金属性铍<镁<钙,以镁的性质推断铍、钙的性质,则B、D项均不正确,C项正确.
本题难度:简单
5、选择题 下列比较正确的是
A.微粒半径Na<Mg<Al
B.还原性Li>Na>K
C.微粒半径O2->F->Na+
D.氧化性F<Cl<Br
参考答案:C
本题解析:
本题难度:困难