微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
⑴能说明上述反应已经达到化学平衡状态的是?(填写序号)
a.v(C)=2v(B)? b.容器内压强保持不变
c.v逆(A)=2v正(B)? d.容器内气体的密度保持不变
⑵若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为?(用含Q1、Q2的代数式表示);
⑶500℃时,上述反应的化学平衡常数K=?;
⑷已知:K(300℃)>K(350℃),该反应是?(填“放”或“吸”)热反应;若反应温度升高,A的转化率?(填“增大”、“减小”或“不变”);
⑸某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)?K(B)(填“>”、“<”或“=”)。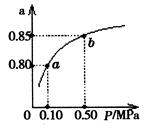
参考答案:(1)bc (2)Q1=4Q2 (3)3200 (4)放热?减小?(5)=
本题解析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。选项a中不能确定反应速率的方向,因此不能确定是否达到平衡状态,a不正确;该反应是体积减小的可逆反应,反应过程中压强是减小的,所以当容器内气体的压强不再发生变化时可以说明达到平衡状态,b正确;c中反应速率的方向相反,且满足反应速率之比是相应的化学计量数之比,可以说明达到平衡状态,c正确;密度是混合气的质量和容器容积的比值,在反应过程中容积内气体的质量和容器容积始终是不变的,即密度始终是不变的,因此选项d不能说明,答案选bc。
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡,则该平衡状态与题干中的平衡状态是相同的。原平衡中,达平衡后测得c(C)=0.040 mol·L-1,放出热量Q1kJ。则该该平衡状态中平衡时c(C)=0.040 mol·L-1,即消耗C的浓度是0.010 mol·L-1,所以Q1=4Q2。
(3)? 2A(g)+B(g) 2C(g)
2C(g)
起始浓度(mol/L)? 0.050? 0.025? 0
转化浓度(mol/L)? 0.040? 0.020? 0.040
平衡浓度(mol/L)? 0.010? 0.005? 0.040
所以平衡常数K=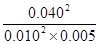 =3200
=3200
(4)已知:K(300℃)>K(350℃),这说明升高温度,平衡向逆反应方向移动,所以该反应是放热反应;因此若反应温度升高,A的转化率减小。
(5)对于特定的可逆反应,平衡常数只与温度有关系,改变压强平衡不移动,则化学平衡常数K(A)=K(B)。
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。该题的难点是等效平衡的应用。
本题难度:一般
2、填空题 硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的11/12,则N2的转化率α1_________;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2_______α1(填“>”、“<”或“=”)。
(2)用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O 4NO+3O2+2H2O=4HNO3
4NO+6H2O 4NO+3O2+2H2O=4HNO3
现以5.1吨液氨为原料来生产质量分数为50%的硝酸,理论上需要加水的质量为_______吨。(假设生产过程中反应物和生成物均无损耗)
(3)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:2NO2+Na2CO3=NaNO2+NaNO3+
CO2,NO+NO2+Na2CO3=2NaNO2+CO2。若在标准状况下有NO、NO2的混合气体(不考虑N2O4)恰好与50mL 1.0 mol·L-1的Na2CO3溶液反应完全,且生成NaNO2和NaNO3的物质的量的比为4:1,则在混合气体中NO气体的体积分数为多少?(请写出计算过程)
参考答案:(1)16.7%;>
(2)13.5
(3)由反应转化关系知,反应过程中钠元素守恒,设NaNO2和NaNO3的物质的量分别为4a mol和a mol,则4a+a=50mL×10-3 mL·L-1×1.0 mol·L-1×2,解得:a=0.02 mol,于是,推出NO、NO2的物质的量分别为:0.03 mol、0.07 mol,即:NO所占的体积分数为30%。
本题解析:
本题难度:一般
3、填空题 (15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
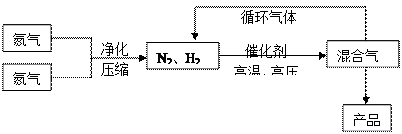
气体
| 氮气
| 氢气
| 氨
|
熔点(℃)
| -210.01
| -252.77
| -77.74
|
沸点(℃)
| -1 95.79 95.79
| -259.23
| -33.42
|
?
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到?℃使混合气体分离出来产品;继续循环的气体是?。
(2)工业上采取用上述 (1)操作的目的:?
(1)操作的目的:?
?。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________?。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
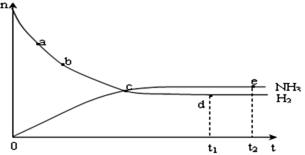
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大?
参考答案:

本题解析:略
本题难度:一般
4、填空题 (10分)在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:
2SO2(g)+O2(g) 2SO3(g)?△H=-196kJ/mol。
2SO3(g)?△H=-196kJ/mol。
初始投料与各容器达到平衡时的有关数据如下:
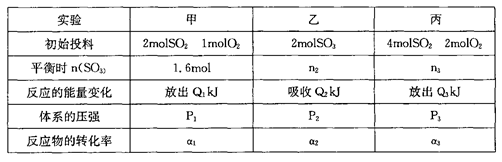
(1)若初始投入a molSO2、b molO2和c molSO3,在相同条件下,要达到与甲相同的化学平衡,则a、c间应满足的代数关系式为_________;b、c间应满足的代数关系式为 _________。
(2)该温度下此反应的平衡常数值为______________,若在相同温度条件下起始投入 0.1molSO2、0.1molO2、0.3molSO3,则反应开始时正逆反应速率的大小关系是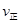 _______
_______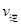
(3)三个容器中的反应分别达平衡时各组数据关系正确的是_______________
A.α1+α2=1
B.Q1+Q2=196
C.α3<α1
D.P3<2P1=2P2
