微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 由两种元素组成的化合物A存在如下图所示的转化关系(部分产物及反应条件已略去)。已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质。L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G。试回答下列问题
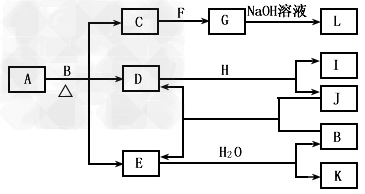
(1)物质K的名称是__________;I的晶体属于____________晶体;
(2)已知A中两种元素原子成最简整数比,且金属元素与非金属元素的质量比为14∶1,则A的化学式为____________。
(3)写出L露置于空气中时,由白色最终转化为红褐色的化学方程式:___________。
(4)写出G与B的稀溶液反应的离子方程式?__________________。
(5)写出A与B反应的化学方程式______________________,若各步反应都看成是进行完全的,则当生成a?mol物质L时,需要A?____________mol。
参考答案:(1)一氧化氮;离子
(2)Fe3C
(3)4Fe(OH )2+ O2 + 2H2O==4Fe(OH)3
(4)3Fe2++4H++NO3-==3Fe3++NO↑+2H2O
(5)Fe3C + 22HNO3==3Fe(NO3)3 + CO2↑+ 13NO2↑+ 11H2O;2a/9或(0.22a)
本题解析:
本题难度:一般
2、填空题 A、B、C、D、E五种常见化合物,都是由下面中的离子形成的:阳离子:K+、Na+、Al3+、Fe3+?阴离子:HCO3—、SO42—、OH-、 Cl—
为了鉴别上述化合物,分别完成以下实验,其结果是:
① 将它们溶于水后,A为棕黄色溶液,其他均为无色溶液;
② 将它们进行焰色反应,仅有C、E为紫色(透过蓝色钴玻璃);
③ 将B溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
④ 在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有D中放出无色气体,只有A、C中产生白色沉淀;
⑤ 将A、E两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出的化学式:A?____,C?。
(2)写出B和D反应的离子方程式?。
(3)进行焰色反应实验操作时,使用铂丝前应该用________洗涤。
(4)在D溶液中加入少量澄清石灰水,其离子方程式为__?__
(5)向100mL 1mol/L C溶液中加入0.2 molBa(OH)2溶液,充分反应后得到溶质是??
参考答案:(8分)(方程式2分,其余各1分)
(1)Fe2(SO4)3?; KAl(SO4)2?
(2) HCO3-+OH-==H2O+CO32-?(3)HCl
(4)Ca2++2HCO3-+2OH-==CaCO3+2H2O+CO32-?(5)Na[Al(OH)4
本题解析:①说明A中有三价铁离子,②说明C、E中有钾离子,③白色沉淀溶解,可能生成的沉淀为氢氧化铝,④确定A、C中有硫酸根离子,D中有碳酸氢根离子,⑤A与E不反应,说明E是氯化钾溶液。综上所述,A为硫酸铁,C为硫酸铝钾,B为氢氧化钠,D为碳酸氢钠,E为氯化钾。
点评:本题涉及到了很多常见离子的检验,比如氯离子,硫酸根离子,碳酸根离子,钾离子等。学生需要在平时多积累常见离子的检验方法,并且要具备一定的推理能力。
本题难度:一般
3、推断题 U、V、W、X、Y、Z是原子序数依次增大的六种短周期元素。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,其在W2中燃烧可生成淡黄色固体。Z的单质在W2中燃烧的产物可使品红溶液褪色。Y的单质也是一种金属,该单质在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)V的单质分子的结构式为_______________;Y W的电子式为____________;
(2)按顺序写出U、V、W与氢元素形成的10电子氢化物的化学式________ 、_________ 、________ ; V、W的氢化物分子结合H+能力较强的是(写化学式)_________。
(3)将ZW2气体通人BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体VW,有关反应的离子方程式为_________________。
参考答案:(1)N≡N ;Mg2+[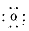 ]2-?
]2-?
(2)CH4 ;NH3;H2O ; NH3?
(3)3SO2 + 2H2O +3Ba2++ 2NO3-==2NO↑ +3BaSO4↓+4H+
本题解析:
本题难度:一般
4、填空题 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图。请针对以下三种不同情况回答:
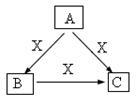
(1)若A、B、C中均含同一种常见金属元素,该元素在 C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素的原子结构示意图为?。
②该金属元素的单质与某红色氧化物在高温下反应,可用于焊接铁轨及定向爆破,已知:1mol该单质完全反应,当温度恢复至298K时,共放热QkJ,请写出该反应的热化学反应方程式为?。
(2)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①用化学方程式表明B溶液呈碱性的原因?。
②自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为___________________。
参考答案:(1)① ②2Al(s)+Fe2O3(s)
②2Al(s)+Fe2O3(s) ?Al2O3(s)+2Fe(s); △H=-2QkJ/mol
?Al2O3(s)+2Fe(s); △H=-2QkJ/mol
(2)①CO32-+H2O OH-+ HCO3-
OH-+ HCO3-
② 2.65 g
本题解析:(1)①若A、B、C中均含同一种常见金属元素,将A、C的水溶液混合可得B的沉淀,由转化关系可知,A含有铝离子,B为氢氧化铝,C含有偏铝酸根,x为氢氧化钠,因此可得出A中含金属元素Al的结构示意图。
②该金属元素的单质与某红色氧化物在高温下反应为铝与Fe2O3发生的铝热反应,配平后Al的系数为2,则△H=-2QkJ/mol,则人化学方程式为2Al(s)+Fe2O3(s) ?Al2O3(s)+2Fe(s); △H=-2QkJ/mol
?Al2O3(s)+2Fe(s); △H=-2QkJ/mol
(2)①若A、B、C的焰色反应均呈黄色,水溶液均为碱性,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,x为二氧化碳。Na2CO3溶液呈碱性的原因是CO32?发生了水解反应,方程式为:CO32-+H2O OH-+ HCO3-。
OH-+ HCO3-。
②溶液中金属阳离子的浓度为0.5 mol?L?1,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为1/2×0.1L×0.5mol/L×106g/mol=2.65g。
本题难度:一般
5、填空题 (16分)A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性。F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末。这些物质之间满足如图所示的转化关系,图中部分生成物已略去。
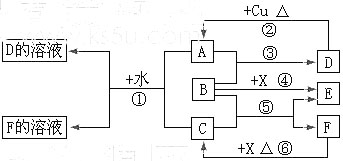
(1)写出下列物质的化学式:A?,F?。
(2)B的电子式为?。根据图中信息,B、C、X的氧化性由强到弱的顺序是?(用化学式表示)。
(3)写出反应①的离子方程式?;
写出反应⑥的离子方程式?。
(4)在反应⑥中,F表现的性质是?,当生成0.75 mol C时,被氧化的还原剂的物质的量是?。
参考答案:(1) SO2? HCl? (各2分)
(2) ? (2分)
? (2分)
MnO2>Cl2>H2O2? (2分)
(3)反应①:Cl2+SO2+2H2O= 4H++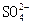 +2Cl-? (2分)
+2Cl-? (2分)
反应⑥: MnO2+4H++2Cl-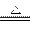 Mn2++Cl2↑+2H2O?(2分)
Mn2++Cl2↑+2H2O?(2分)
(4)还原性、酸性? (2分)? 1.5 mol?(2分)
本题解析:略
本题难度:简单