微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列表明金属甲比金属乙活动性强的叙述,正确的是
[? ]
A.在氧化还原反应中,甲失电子数比乙多
B.同价态阳离子甲比乙氧化性强
C.甲能与盐酸反应放出H2,而乙不能
D.甲、乙与H2SO4溶液形成原电池,乙上冒气泡
参考答案:CD
本题解析:
本题难度:一般
2、选择题 在理论上可用于设计原电池的化学反应是?
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D.FeCl3(aq)十3H2O(1)  Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
参考答案:A
本题解析:原电池是把化学能转化为电能的装置。所以化学反应如果能设计成原电池,则该反应应该是氧化还原反应。A.是氧化还原反应,能设计原电池。正确。B、C、D的反应都不是氧化还原反应,因此都不可以设计为原电池。错误。因此选项为A。
本题难度:一般
3、选择题 中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备.下列关于这三个工业生产的描述中正确的是( )
A.电解法制金属钠时,负极反应式:Na++e-=Na,
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是?H2,NaOH?在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl,在电解时它们的阴极都是?C1一失电子
参考答案:B
本题解析:
本题难度:简单
4、填空题 (共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) CO(g)
CO(g) CH3OH(g)
CH3OH(g) 90.8 kJ
90.8 kJ
② 2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)
H2O(g) 23.5 kJ
23.5 kJ
③ CO(g) H2O(g)
H2O(g) CO2(g)
CO2(g) H2(g)
H2(g) 41.3 kJ
41.3 kJ
总反应:3H2(g) 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,其中Q
Q,其中Q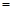 kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压? b.加入催化剂? c.减少CO2的浓度? d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g) CH3OCH3(g)
CH3OCH3(g) H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
物质
| CH3OH
| CH3OCH3
| H2O
|
浓度/(mol·L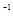 ) )
| 0.44
| 0.6
| 0.6
|
比较此时正、逆反应速率数值(单位相同)的大小: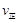 (甲醇)
(甲醇) 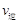 (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。
反应开始时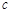 (CH3OH)
(CH3OH)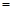 ? ;
? ;
该时间内的平均反应速率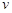 (CH3OH)
(CH3OH)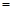 ;
;
该温度下反应的平衡常数值为 。(精确到0.01)
参考答案:(1).C +H2O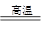 CO +H2?(1分)?(2).H2S+Na2CO3 →NaHS + NaHCO3 (1分)
CO +H2?(1分)?(2).H2S+Na2CO3 →NaHS + NaHCO3 (1分)
(3).246.4 (2分)? a c? (2分)
(4).>? (1分)? 1.64 mol·L-1?(1分)? 0.12mol/L·min? (1分)? 1.86 (1分)
本题解析:(1)碳在高温下和水蒸气反应,即生成水煤气,反应式为C +H2O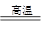 CO +H2 。
CO +H2 。
(2)两种酸式盐分别是NaHS和 NaHCO3,所以方程式为H2S+Na2CO3 →NaHS + NaHCO3。
(3).根据盖斯定律可知,①×2+②+③即得到3H2(g) 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g) CO2(g)
CO2(g) Q,所以Q=90.8 kJ×2+23.5 kJ+41.3 kJ=246.4kJ。由于正反应是体积减小的、放热的可逆反应,所以a正确。催化剂不能改变平衡状态,b不正确,才是降低生成物的浓度,平衡向正反应方向移动,正确。d中平衡虽然向正反应方向移动,但CO的转化率是降低的,不正确。
Q,所以Q=90.8 kJ×2+23.5 kJ+41.3 kJ=246.4kJ。由于正反应是体积减小的、放热的可逆反应,所以a正确。催化剂不能改变平衡状态,b不正确,才是降低生成物的浓度,平衡向正反应方向移动,正确。d中平衡虽然向正反应方向移动,但CO的转化率是降低的,不正确。
(4).根据水利之比是相应的化学计量数之比可知,甲醇的反应速率大于水蒸气的反应速率。平衡时生成水蒸气是0.6mol/L的,则消耗甲醇是1.2mol/L的,所以开始是甲醇的浓度是1.2mol/L+0.44mol/L=1.64mol/L。平衡常数是反应达到化学平衡时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以是
本题难度:一般
5、选择题 下列各组电极均用导线相连,分别插入对应溶质的溶液中,其中不能组成原电池的是
[? ]
电极与溶液
A.
Zn、C 硫酸?
B.
Cu、Ag 硝酸银
C.
Zn、Cu 蔗糖
D.
Mg、Al 氢氧化钠
参考答案:C
本题解析:
本题难度:简单