微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA代表阿伏加德罗常数,下列叙述错误的是
A.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数小于9.8%
B.在H2O2+Cl2 2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.NA个一氧化碳分子和0.5mol甲烷的质量比为7:2
参考答案:A
本题解析:
A、硫酸溶液浓度越大,密度越大
设原溶液的密度为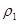 ,溶质的质量为m,则:
,溶质的质量为m,则: ,推出
,推出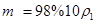 ;
;
设原溶液的密度为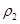 ,则其质量分数为:
,则其质量分数为: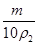 =
=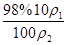 =9.8%×
=9.8%×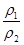 >9.8%
>9.8%
B、在H2O2+Cl2 2HCl+O2反应中,两个—1价氧升为0价,两个0价氯降至—1价,故有两个电子的转移。由方程式可看出,每生成32g氧气,则转移2NA个电子转移
2HCl+O2反应中,两个—1价氧升为0价,两个0价氯降至—1价,故有两个电子的转移。由方程式可看出,每生成32g氧气,则转移2NA个电子转移
C、CO、C2H4的摩尔质量相同,所以标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L(阿伏加德罗定律适用于纯净或混合气体),质量为28g
D、NA个一氧化碳分子和0.5mol甲烷的质量比为28:8即7:2
故答案为A
本题难度:一般
2、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA
B.标准状况下,2.24 LNO2与水反应生成NO3-的数目为0.1NA
C.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA
D.4.0 g H2与足量O2完全反应生成水,反应中断裂共价键的总数为2NA
参考答案:C
本题解析:
试题分析:A、25℃时,pH=13的氨水中OH-的浓度是0.1mol/L,但不能确定溶液的体积,因此不能计算OH-的数目,A不正确;B、标准状况下,2.24 LNO2的物质的量=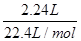 =0.1mol。NO2与水反应的方程式为3NO2+H2O =2HNO3+NO,在反应中氮元素的化合价从+4价部分升高到+5价,部分降低到+2价,因此0.1molNO参加反应转移电子的物质的量是
=0.1mol。NO2与水反应的方程式为3NO2+H2O =2HNO3+NO,在反应中氮元素的化合价从+4价部分升高到+5价,部分降低到+2价,因此0.1molNO参加反应转移电子的物质的量是 ×0.1mol,B不正确;C、钠在反应中只能失去1个电子,因此1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA,C正确;D、4.0g氢气的物质的量=4g÷2g/mol=2mol,与氧气反应消耗1mol。氢气含有1个单键,氧气含有1个双键因此共断裂共价键的总数=(2+1)NA=3NA,D不正确,答案选C。
×0.1mol,B不正确;C、钠在反应中只能失去1个电子,因此1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA,C正确;D、4.0g氢气的物质的量=4g÷2g/mol=2mol,与氧气反应消耗1mol。氢气含有1个单键,氧气含有1个双键因此共断裂共价键的总数=(2+1)NA=3NA,D不正确,答案选C。
本题难度:一般
3、选择题 一定量的质量分数为14%的KOH溶液,若将其蒸发掉100 g水后,其质量分数为28%,体积为80 mL,则浓缩后的KOH的物质的量浓度为
A.2.2 mol·L-1
B.4 mol·L-1
C.5 mol·L-1
D.6.25 mol·L-1