微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.(4分)实验室有一瓶澄清的溶液,实验人员确定其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-,取该溶液进行下列实验:
①取pH试纸检验,表明溶液呈强酸性。
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生。
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成。
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
⑥向②的水层中加入HNO3酸化的AgNO3溶液有白色沉淀。
根据上述实验事实确定,请你判断该溶液中
(1)肯定存在的离子是?;
(2)不能确定是否存在的离子是?。
Ⅱ. (6分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式?。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是?。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+ 4KI+ 4HNO3→Se+2I2+ 4KNO3+2H2O?②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为?。
参考答案:Ⅰ.(4分)(1)I-、Ba2+、NH4+(2分)(2)K+、Na+、Cl?(2分)
Ⅱ. (6分)(1)Se+2HNO3(浓)=SeO2+NO↑+NO2↑+H2O (2分)
(2)H2SO4(浓)>SeO2>SO2(2分)(3)92.5%(2分)
本题解析:Ⅰ.根据实验(1)现象:溶液呈强酸性,说明溶液中肯定含有H+,而H+与CO32-发生反应而不能共存,说明溶液中肯定不含有CO32-;根据实验(2)现象:CCl4层呈紫红色,说明有I2,这是由于I-被氯气氧化所产生的,从而说明溶液中含有I-,而I-与Fe3+、NO3-和H+-发生反应而不能共存,说明溶液中肯定不含有Fe3+、NO3-;根据实验(3)现象:溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,而Mg2+、Al3+能与碱反应产生沉淀,说明溶液中肯定不含有Mg2+、Al3+;根据实验(4)现象:取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,说明溶液中肯定含有Ba2+,而Ba2+能与SO42-产生沉淀,说明溶液中不含SO42-;根据实验(5)现象:产生的气体能使湿润的红色石蕊试纸变蓝,则该气体为氨气,说明溶液中肯定含NH4+;根据实验(6)现象:步骤②加入了氯水,产生了Cl?,所以无法原溶液是否含有Cl?,综上所述,(1)在提供的离子中肯定含有的离子为:I-、NH4+、Ba2+,(2)不能确定的离子为:K+、Na+、Cl-。
Ⅱ. (1)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1,令二者系数为1,根据电子转移守恒可知,Se的系数为(1×3+1×1)÷4=1,故反应方程式为:Se+2HNO3(浓)=H2SeO3+NO↑+NO2↑。
(2)在氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性,所以根据反应的方程式可知,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2。
(3)根据反应的方程式可知SeO2~2I2~4Na2S2O3,消耗的n(Na2S2O3)=0.2000?mol/L×0.025L=0.005mol,根据关系式计算样品中n(SeO2)=0.005mol×1/4=0.00125mol,故SeO2的质量为0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数为0.13875g÷0.1500g×100%=92.5%。
本题难度:困难
2、选择题 下列哪一种反应不属于取代反应
A.甲烷跟氯气见光
B.溴乙烷跟NaOH乙醇溶液共热
C.苯跟浓硫酸共热
D.2氯丙烷跟KOH水溶液共热
参考答案:B
本题解析:A. 烷烃的取代反应;B. 卤代烃NaOH醇溶液的消去反应;C. 苯的碘化 ( 取代 ) 反应;D. 卤代烃KOH水溶液的水解 ( 取代 ) 反应。
本题难度:一般
3、选择题 下列反应的离子方程式正确的是?(?)
A.苯酚钠溶液中通入少量CO2:CO2 + H2O + C6H5O-→C6H5OH + HCO3-
B.浓盐酸与MnO2反应制取氯气:MnO2+2H++2Cl-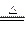 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入少量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.用惰性电极电解氯化镁溶液:2Cl-+ 2H2O 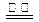 H2↑+ Cl2↑+2OH-
H2↑+ Cl2↑+2OH-
参考答案:A
本题解析:A项苯酚钠溶液中通入CO2反应的离子方程式与CO2通入的量无关,无论少量还是过量均为CO2 + H2O + C6H5O-= C6H5OH + HCO3-;B项电荷及元素均不守恒;C项应该生成CO32-;D项应该有Mg(OH)2↓生成。
本题难度:简单
4、选择题 某10 mL溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、K+、Fe3+、Mg2+、Al3+等离子,向溶液中逐滴加人1 mol/L的盐酸,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中正确的是(?

A.原溶液肯定含有OH-、CO32-、AlO2-、SiO32-、Na+
B.若原溶液中只含有某一种阳离子(不考虑水电离出来的氢离子)且忽略反应前后溶液体积变化,那么该离子在原溶液中的物质的量浓度为等
C.原溶液中n(CO32-):n(AlO2-)=3:4
D.a值肯定等于4
参考答案:C
本题解析:根据题给图像知,开始向溶液中逐滴加人1 mol/L的盐酸无沉淀生成,说明加入的盐酸和溶液中的OH-反应,则溶液中存在大量氢氧根离子,与氢氧根离子反应的离子不能共存,溶液中一定没有Fe3+、Mg2+、Al3+;随着盐酸加入量的增加,反应生成沉淀逐渐增大,然后不变,最后沉淀量逐渐减少但不消失,说明溶液中AlO2-、SiO32-和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,继续加入盐酸沉淀量不变,消耗盐酸的离子只能是CO32-离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定是否存在,根据溶液的电中性原则可知,溶液中K+、Na+至少存在一种。A、根据上述分析知,原溶液中肯定含有的离子是:OH-、SiO32-、AlO2-、CO32-,K+、Na+至少存在一种,错误;B、溶液中硫酸根离子不能确定是否存在,无法计算溶液中阳离子的物质的量浓度,错误;C、根据题给图像分析,与碳酸根离子反应的盐酸为2体积,氢氧化铝溶解消耗的盐酸体积为4体积,结合反应CO32-+2H+=CO2↑+H2O ,Al(OH)3+3H+=Al3++3H2O分析,原溶液中含有CO32-与AlO2-的物质的量之比为3:4,正确;D、溶液中氢氧根的物质的量无法确定,无法计算a值,错误。
本题难度:一般
5、选择题 能正确表示下列反应的离子反应方程式的是
A.Na2O2?溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.将铝粉加入到NaOH溶液中溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
参考答案:C
本题解析:分析:A.原子不守恒;
B.恰好使SO42-沉淀完全,1:2反应,生成硫酸钡、偏铝酸钾;
C.反应生成偏铝酸钠和氢气;
D.反应生成氢氧化铜、氢气.
解答:A.Na2O2?溶于水产生O2的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故A错误;
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,故B错误;
C.将铝粉加入到NaOH溶液中溶液中的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故C正确;
D.钠与CuSO4溶液反应的离子反应为2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确离子反应的实质、离子反应中保留化学式的物质是解答本题的关键,注意选项D中不能发生置换反应,题目难度不大.
本题难度:困难