| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《化学基本概念》高频试题预测(2017年最新版)(十)
参考答案:A 本题解析:氧化剂在反应中得到电子,元素的化合价降低。还原剂在反应中失去电子,元素的化合价升高,所以如果变化中,需加入适当的氧化剂才能完成,这就说明选项中的微粒是还原剂,有关元素的化合价是升高的。A中铁的化合价升高,需要加入氧化剂。B中铜元素的化合价降低,需要加入还原剂。C中N元素的化合价降低,需要加入还原剂。D中元素的化合价不变,不需要加入氧化剂或还原剂,答案选A。 本题难度:一般 2、选择题 已知氧化还原反应反应 K2Cr2O7 + 14HCl |
参考答案:A
本题解析:①Cr元素化合价由+6价降低为+3价,所以K2Cr2O7为氧化剂,正确;②HCl为还原剂,Cr3+为还原产物,还原剂的还原性大于还原产物,所以还原性:Cl->Cr3+,正确;③根据化合价的变化,每生成1mol Cl2,电子转移为2mol,错误;④CrCl3是还原产物,错误,故A项正确。
考点:本题考查氧化还原反应原理。
本题难度:一般
3、选择题 向蒸馏水中加入一定量的NaHSO3晶体,保持常温,测得溶液的pH=4,下列说法正确的是
A.水电离出的H+的浓度是1.0×10-4 mol·L-1
B.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3)
C.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-)
D.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3)
参考答案:D
本题解析:考点:离子浓度大小的比较;弱电解质在水溶液中的电离平衡;水的电离;盐类水解的应用.
分析:测得溶液的pH=4,说明溶液呈酸性,溶液中HSO3-离子的电离程度大于水解程度,结合弱电解质的电离和盐类的水解原理以及溶液中的电荷守恒、质子守恒、物料守恒解答该题.
解:A.测得溶液的pH=4,说明HSO3-电离出的H+的浓度是1.0×10-4mol?L-1,水电离出的H+的浓度等于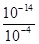 mol?L-1=1.0×10-10mol?L-1,故A错误;
mol?L-1=1.0×10-10mol?L-1,故A错误;
B.根据物料守恒可知,Na元素的物质的量与S元素的物质的量相等,则存在c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故B错误;
C.根据电荷守恒,溶液中存在c(HSO3-)+2c(SO32-)+c(OH-)=c(Na+)+c(H+),根据无聊守恒,溶液中存在c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),二者联式可得:c(H+)+c(H2SO3)-c(SO32-)=c(OH-),故C错误;
D.溶液的pH=4,说明溶液呈酸性,溶液中HSO3-离子的电离程度大于水解程度,则c(SO32-)>c(H2SO3),一般来说,弱电解质的电离程度都较小,应有c(HSO3-)>c(SO32-),则c(HSO3-)>c(SO32-)>c(H2SO3),故D正确.
故选D.
本题难度:一般
4、选择题 25℃时,浓度均为0.1mol/L的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是
A.在0.1mol/LBA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-)
B.若将0.1mol/LBOH溶液稀释至0.001mol/L,则溶液的pH=9
C.若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+)
D.若将上述两溶液按体积比1:2混合,则混合液中:c(B+)>c(A-)>c(BOH)>c(OH-)>c(H+)
参考答案:D
本题解析:试题分析:根据pH可以确定,HA为强酸,而BOH为弱碱;A、根据电荷守恒有c(B+)+c(H+)=c(A-)+c(OH-),物料守恒有c(B-)+c(BOH)=c(A-),二者相减得到c(H+)=c(BOH)+c(OH-)(质子守恒),错误;B、因为BOH为弱碱,在稀释过程中,电离程度增大,故pH>9,错误;C、pH=7,c(H+)=c(OH-),根据电荷守恒,c(A-)=c(B+),错误。D、混合后为等浓度BA和BOH共存的溶液,一般电离大于水解,故正确。
考点:考查电解质溶液,涉及弱电解质的电离和盐类水解,三大守恒的应用等相关关系。
本题难度:困难
5、选择题 已知下列反应:
(1)2A3++2B-====2A2++B2
(2)C2+2B-====2C-+B2
(3)2A2++C2====2A3++2C-
下列有关物质氧化性、还原性强弱的判断,正确的是
A.氧化性:B2>C2>A3+
B.还原性:A2+>C->B-
C.氧化性:C2>A3+>B2
D.还原性:C->A2+>B-
参考答案:C
本题解析:(排除法)(1)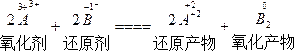
氧化性:A3+>B2,A选项被排除。还原性:B->A2+,B、D选项都被排除。由此已知答案,(2)、(3)可不分析。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《原电池原理.. | |