微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将金属钠投入到下列物质的溶液中,溶液的质量不会减轻的是
A.HCl
B.CuSO4
C.MgCl2
D.Ca(HCO3)2
参考答案:A
本题解析:溶液质量的变化取决于加入物质与逸出气体和析出沉淀的质量之差。若此差值大于等于零,则溶液质量不会减轻。
A项中:
2Na+2HCl====2NaCl+H2↑?Δm
2×23?2? 44>0
B项中:
2Na+2H2O+CuSO4====Na2SO4+Cu(OH)2↓+H2↑?Δm
2×23? 98? 2? -54<0
C项中:
2Na+2H2O+MgCl2====2NaCl+Mg(OH)2↓+H2↑?Δm
46? 58? 2? -14<0
D项中:
2Na+2H2O====2NaOH+H2↑
2NaOH+Ca(HCO3)2====CaCO3↓+Na2CO3+2H2O
二者合并为
2Na+Ca(HCO3)2====CaCO3↓+Na2CO3+H2↑?Δm
46? 100? 2? -56<0
本题难度:一般
2、选择题 SO2和Cl2(湿润)都具有漂白性.若将二者分别通入品红溶液,再加热品红溶液,颜色可恢复的是
A.SO2
B.Cl2
C.二者皆可
D.二者皆不可
参考答案:A
本题解析:漂白原理不同,Cl2漂白是破坏色质结构,不可恢复,SO2是和色质结合成无色物,可分解恢复.
本题难度:简单
3、选择题 下列关于卤素及其化合物的叙述中正确的是
A.SO2使溴水褪色是利用了SO2的漂白性
B.用溴水、淀粉-KI溶液可以检验Br2与I2的氧化性强弱
C.Cl、Br、I的非金属性依次增强,所以其最高价氧化物对应水化物的酸性依次减弱
D.Cl2与NH3反应生成N2和NH4Cl,制氯气工厂可用该反应来检验氯气是否泄漏
参考答案:BD
本题解析:分析:A.二氧化硫与溴水发生氧化还原反应生成硫酸和HBr;
B.溴与KI发生氧化还原反应生成单质碘,氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;
C.非金属性越强,其最高价氧化物的水化物的酸性越强;
D.Cl2与NH3反应生成N2和NH4Cl,能观察到白烟.
解答:A.SO2使溴水褪色,是因二氧化硫与溴水发生氧化还原反应生成硫酸和HBr,体现二氧化硫具有还原性,故A错误;
B.溴与KI发生氧化还原反应,碘遇淀粉变蓝,说明生成单质碘,由氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,可知Br2与I2的氧化性强弱,故B正确;
C.非金属性越强,其最高价氧化物的水化物的酸性越强,则Cl、Br、I的非金属性依次减弱,所以其最高价氧化物对应水化物的酸性依次减弱,故C错误;
D.Cl2与NH3反应生成N2和NH4Cl,能观察到白烟,根据该反应原理可利用蘸有浓氨水的玻璃棒来检验氯气是否泄漏,故D正确;
故选BD.
点评:本题考查氯、溴、碘及其化合物的性质,侧重物质性质的考查,涉及氧化还原反应、氧化性的比较、非金属性与酸性的比较等,注重知识的归纳和基础知识的考查,题目难度不大.
本题难度:困难
4、选择题 在标准状况下,取甲、乙、丙各100mL相同浓度的盐酸,分别加入组成相同的镁铝合金粉末,得到的气体体积(标准状况)与合金的质量有关数据如下表;
A.甲组中盐酸过量,丙组中金属过量
B.盐酸的物质的量浓度为1mol/L
C.合金中镁,铝的物质的量之比是1:1
D.向甲容器中继续加入350mL1.00mol?L-1NaOH溶液时,生成沉淀0.1mol
参考答案:BD
本题解析:分析:甲中加入2.55g合金时生成气体的体积为2.80L,继续加入合金,最多生成3.36L气体,说明甲中盐酸过量,且生成气体最多为3.36L,根据反应的相关方程式计算.
解答:A.甲中加入2.55g合金时生成气体的体积为2.80L,继续加入合金,最多生成3.36L气体,说明甲中盐酸过量,金属不足,分别加入金属3.85g和4.59g时,生成气体的体积相等,则说明丙组中金属过量,故A正确;
B.不管加多少镁铝合金,最多只能生成3.36L的氢气,说明盐酸最多只能产生3.36L的氢气.所以就3.36L来计算盐酸的物质的量. 气体的物质的量为: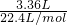 =0.15mol,
=0.15mol,
根据方程式,可计算出HCl的物质的量为0.15mol×2=0.3mol,盐酸的物质的量浓度为: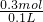 =3mol/L,故B错误;
=3mol/L,故B错误;
C.由于甲组中,盐酸是过量的,所以用甲组来计算,设Mg的物质的量为x,Al的物质的量为y,
生成气体的物质的量为: =0.125mol,
=0.125mol,
依题意得:24x+27y=2.55g;x+ y=0.125mol,
y=0.125mol,
解方程组得:x=0.05;y=0.05,
所以物质的量之比为1:1,
故C正确;
D.当甲中Mg2+、Al3+全部生成沉淀时,溶液的溶质为NaCl,已知n(Cl-)=0.15mol×2=0.3mol,则需1.00mol?L-1NaOH溶液
300ml,此时加入350mL1.00mol?L-1NaOH溶液,则有Al(OH)3+OH-=AlO2-+2H2O,所以沉淀的物质的量小于0.1mol,故D错误;
故选BD.
点评:本题考查混合物的计算,题目难度较大,注意根据表中数据判断合金与盐酸反应的过量问题为解答本题的关键.
本题难度:困难
5、选择题 下列物质转化在给定条件下不能实现的是
A.Fe2O3FeCl3(aq)无水FeCl3
B.Al2O3NaAlO2(aq)AlCl3
C.NH3NOHNO3
D.饱和NaCl(aq)NaHCO3Na2CO3
参考答案:A
本题解析:分析:A、氧化铁与盐酸反应生成氯化铁,Fe3+水解,加热蒸发得不到无水FeCl3;
B、氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液加入盐酸,生成氯化铝;
C、氨气的催化氧化会生成一氧化氮,一氧化氮易被氧化为二氧化氮,二氧化氮溶于水中得到硝酸;
D、在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以析出NaHCO3,加热NaHCO3分解生成碳酸钠.
解答:A、氧化铁与盐酸反应生成氯化铁,Fe3+水解Fe3++3H2O?2Fe(OH)3+HCl,加热蒸发HCl挥发,平衡向右移动,得不到无水
FeCl3,故A选;
B、氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液加入盐酸,生成氯化铝,故B不选;
C、氨气的催化氧化会生成一氧化氮,一氧化氮易被氧化为二氧化氮,二氧化氮溶于水中得到硝酸,故C不选;
D、在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,析出NaHCO3,加热NaHCO3分解生成碳酸钠,故D不选.
故选A.
点评:本题考查学生元素化合物、侯氏制碱法、盐类的水解等方面的知识,注意知识的梳理和归纳是解题的关键,难度不大.
本题难度:困难