微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 30mL0.05mol/LNa2SO3溶液恰好与50mL0.02mol/LKXO4溶液完全反应转化为Na2SO4.则X元素在产物中的化合价是
A.+2
B.+3
C.+4
D.+5
参考答案:C
本题解析:分析:Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;KXO4中X元素发生还原反应,令X元素在产物中的化合价为a价,根据电子转移守恒计算a的值.
解答:令X元素在产物中的化合价为a价,根据电子转移守恒,则:
30×10-3L×0.05mol/L×(6-4)=50×10-3L×0.02mol/L×(7-a)
解得a=+4
故选:C.
点评:考查氧化还原反应计算、氧化还原反应概念等,难度中等,表示出得失数目是解题关键.熟练掌握电子转移守恒思想的运用.
本题难度:一般
2、选择题 下列物质敞口放置或暴露于空气中,质量增加的是
A.浓盐酸
B.浓硫酸
C.浓硝酸
D.硅酸
参考答案:B
本题解析:考查常见酸的性质。浓硫酸具有吸水性,所以敞口放置或暴露于空气中,质量会增加。浓盐酸具有挥发性,质量减少。浓硝酸易挥发、易分解,质量减少。硅酸是固体,易脱水,质量减少。所以答案选B。
本题难度:一般
3、选择题 下列反应能以离子方程式OH-+H+=H2O表示的是
A.氢氧化钾和醋酸
B.氢氧化镁和盐酸
C.氢氧化钡和稀硫酸
D.氢氧化钠和稀硫酸
参考答案:D
本题解析:分析:稀的强酸与稀的强碱反应生成可溶性盐和水的反应,可用离子反应OH-+H+=H2O表示.
解答:A、氢氧化钾和醋酸的离子反应为OH-+HAc=H2O+Ac-,故A不选;
B、氢氧化镁和盐酸反应的离子反应为Mg(OH)2+2H+=2H2O+Mg2+,故B不选;
C、氢氧化钡和稀硫酸反应的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C不选;
D、氢氧化钠和稀硫酸反应的离子反应为OH-+H+=H2O,故D选;
故选D.
点评:本题考查离子方程式的书写,明确常见的物质的溶解性、弱电解质在离子反应中应保留化学式是解答本题的关键,难度不大.
本题难度:简单
4、选择题 将铝粉与某铁的氧化物FeO?2Fe2O3粉末配制成铝热剂,分成两等份.一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为7.84L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A.5.6L
B.7.84L
C.11.2L
D.15.68L
参考答案:A
本题解析:分析:分成两等份.一份直接放入足量的烧碱溶液中,只有铝与氢氧化钠发生反应生成氢气,7.84L为氢气体积,根据氢气的体积计算出铝的物质的量.另一份在高温下恰好反应完全,实质为铝置换出铁,铁的氧化物FeO?2Fe2O3中的氧原子全部与铝结合生成氧化铝,利用氧原子守恒,根据铝的物质的量,计算出氧原子的物质的量,再结合氧化物FeO?2Fe2O3的化学式计算出其物质的量,再根据铁原子守恒,可知生成的铁的物质的量.根据铁的物质的量计算铁与盐酸反应生成的氢气体积.
解答:一份直接放入足量的烧碱溶液中,铝与氢氧化钠发生反应生成氢气7.84L,
氢气的物质的量为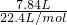 =0.35mol.
=0.35mol.
铁的氧化物FeO?2Fe2O3中的氧原子全部与铝结合生成氧化铝,
所以根据关系式3H2~~~~2Al~~~~3O~~~~Al2O3
?3?2? 3
? ?0.35mol? 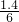 mol?0.35mol
mol?0.35mol
由于氧化物为FeO?2Fe2O3,根据氧原子守恒,所以氧化物FeO?2Fe2O3的为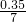 =0.05mol.
=0.05mol.
根据铁原子守恒,可知另一份生成的铁的物质的量为0.05mol×5=0.25mol.
根据Fe~H2可知,0.25molFe可生成氢气0.25mol,所以另一份生成的氢气的体积为0.25mol×22.4L/mol=5.6L.
故选A.
点评:本题考查混合物的计算、铝的性质,题目难度较大,关键清楚反应过程.本解法在反应的基础上利用原子守恒,简化计算步骤,注意守恒思想的灵活运用.
本题难度:困难
5、选择题 光纤的主要成分是
A.纯硅
B.铜
C.玻璃
D.二氧化硅
参考答案:D
本题解析:试题分析:光纤的主要成分是二氧化硅,答案选D。
考点:考查二氧化硅的用途
点评:该题是常识性知识的考查,试题基础性强,难度不大。该题的关键是学生要熟练记住常见物质的性质和用途。
本题难度:困难