微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 如图所示A~H为实验室常见的仪器、装置(部分固定夹持装置略去),请根据要求回答下列问题
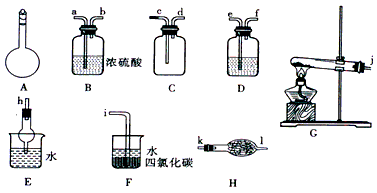
(1)A仪器的名称是_____________,常用于_____________。
(2)用图中所示仪器设计一套制取一瓶干燥、纯净氨气的实验装置,仪器的连接顺序是(用管口字母符号表示):j接__________________________。
为了研究Cl2的性质,设计如图所示装置进行实验(装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸)。
(3)加入药品前,检查Ⅰ中气体发生装置气密性的操作是_________________________________
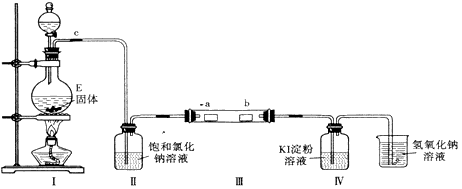
(4)实验过程中,装置Ⅳ中的实验现象为________________________。
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化“这一预期现象。为了达到这一实验目的,你认为应在__________之间(选填装置序号)还需添加一个洗气瓶,该装置的作用是__________________________。
2、填空题 某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为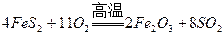 ,在该反应中____________做氧化剂;若消耗了
,在该反应中____________做氧化剂;若消耗了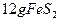 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_______________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成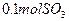 ,可放出
,可放出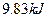 的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_?____________________________。
的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_?____________________________。
3、选择题 将过量的氯气通入30mL浓度为10.0mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3的共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.15 mol
B.当反应中被氧化的氯元素和被还原的氯元素之比为1:4时,溶液中NaClO和NaClO3的物质的量之比为3:1
C.溶液中n(Na+):n(Cl-)可能为7:3
D.若Cl2与NaOH的反应中转移的电子为n mol,则0.15<n<0.35
4、选择题 某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O),经测定ClO-与ClO3-的物质的量之比为1:3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.21:5
B.11:3
C.3:1
D.4:1
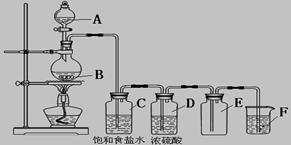
5、实验题 (8分)以下是实验室制取氯气的装置,在图中饱和食盐水的作用是_____________,
浓硫酸的作用是____________________,F中盛放的溶液是__________________________,
起的作用是_____________________________。