|
高考化学知识点归纳《化学平衡》试题预测(2017年最新版)(二)
2017-08-08 04:14:02
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:
MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
| 选项 | x | y
A
温度
容器内混合气体的密度
B
CO的物质的量
CO2与CO的物质的量之比
C
SO2的浓度
平衡常数K
D
MgSO4的质量(忽略体积)
CO的转化率
|
A.A
B.B
C.C
D.D
|
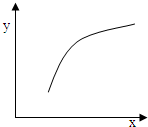
参考答案:该反应为正方向体积增加且吸热.
A、升高温度,平衡正向移动,气体的质量增加,密度增大,故A正确;
B、增加CO的量,平衡正向移动,但压强增大,转化的量,没有上一平衡多,故比值减小,故B错误;
C、平衡常数只与温度有关,浓度变化平衡常数不变,故C错误;
D、因MgSO4为固体,增加其量,对CO的转化率无影响,故D错误;
故选A.
本题解析:
本题难度:简单
2、选择题 对于如下反应,其反应过程的能量变化示意图如图:
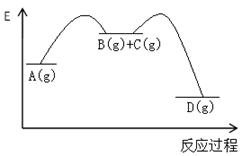
编号
| 反应
| 平衡常数
| 反应热
| 反应①
| A(g)=B(g)+C(g)
| K1
| △H1
| 反应②
| B(g)+C(g)=D(g)
| K2
| △H2
| 反应③
| A(g)= D(g)
| K3
| △H3
|
下列说法正确的是
A.K3 =K1 + K2 B.△H3=△H1+△H2
C.加催化剂,反应①的反应热降低,反应速率加快
D.则增大压强,K1减小,K2增大,K3不变
参考答案:B
本题解析:由反应可知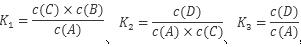 、,故K3 =K1 × K2,故A项错误;由盖斯定律可知△H3=△H1 +△H2,故B项正确;催化剂只能降低反应活化能,是活化分子百分率增多,反应速率加快,但不会影响反应热,故C项错误;化学平衡常数只与温度有关,增大压强反应温度不变,故各反应的平衡常数不变,故D项错误;本题选B。 、,故K3 =K1 × K2,故A项错误;由盖斯定律可知△H3=△H1 +△H2,故B项正确;催化剂只能降低反应活化能,是活化分子百分率增多,反应速率加快,但不会影响反应热,故C项错误;化学平衡常数只与温度有关,增大压强反应温度不变,故各反应的平衡常数不变,故D项错误;本题选B。
考点:化学平衡及能量变化。
本题难度:困难
3、选择题 已知可逆反应: A + 2B 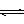 3M + N ;△H<0,其中A.B.M.N均为气态, 在一定条件下达到平衡后, A 在反应混合物中的百分含量为 a% , 若要通过改变条件使 a% 改变为 2a%, 那么下列各项可以改变的条件中应选择的是: 3M + N ;△H<0,其中A.B.M.N均为气态, 在一定条件下达到平衡后, A 在反应混合物中的百分含量为 a% , 若要通过改变条件使 a% 改变为 2a%, 那么下列各项可以改变的条件中应选择的是:
A.增大容器体积 B.增大反应容器中的压强
C.降温反应的温度 D.使用适当的催化剂
参考答案:B
本题解析:根据方程式可知,该反应是体积增大的、放热的可逆反应,所以要通过改变条件使 a% 改变为 2a%,则应该使平衡向逆反应方向移动,所以选项B正确。AC中平衡向正反应方向移动,D中平衡不移动,答案选B。
考点:考查外界条件对平衡状态的影响
点评:该题是高考中的常见题型,属于基础性试题的考查。主要是考查学生灵活运用勒夏特列原理解决实际问题能力的培养,有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑思维能力。
本题难度:困难
4、选择题 下列关于化学反应限度的叙述错误的是( )
A.不同的化学反应,限度可能不同
B.可以通过改变温度来控制化学反应的限度
C.可以通过改变某反应物的量来改变反应的限度
D.当一个化学反应在一定条件下达到限度时,正,逆反应速率便停止
参考答案:A、可逆反应不论反应到什么程度,都会含有所有反应物和所有生成物,即会达到一定的限度,不同的化学反应,限度可能不同,故A正确;
B、一个可逆反应达到化学平衡状态后,当条件温度改变时,原来的化学平衡状态就会被破坏,并在新的条件下建立新的化学平衡状态,以通过改变温度来控制化学反应的限度,故B正确;
C、一个可逆反应达到化学平衡状态后,当某反应物的量改变时,原来的化学平衡状态就会被破坏,并在新的条件下建立新的化学平衡状态,可以通过改变某反应物的量来改变反应的限度,故C正确;
D、当一个化学反应在一定条件下达到限度时,正、逆反应仍在进行,速率不为零,故D错误.
故选D.
本题解析:
本题难度:简单
5、填空题 (10分)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。
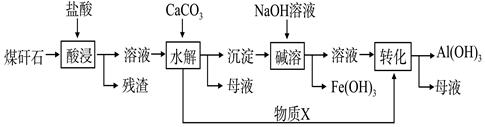
(1)写出“酸浸”过程中主要反应的离子方程式(任写一个):
。
(2)物质X的化学式为________。“碱溶”时反应的离子方程式为_____________________________。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是 ,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3饱和溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因: 。
参考答案:(10分)
(1)Al2O3+6H+===2Al3++3H2O 【 或Fe2O3+6H+===2Fe3++3H2O 】
(2)CO2 Al(OH)3+OH-===AlO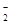 +2H2O +2H2O
(3)加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后
(4)AlCl3饱和溶液中存在溶解平衡AlCl3·6H2O(s) Al3+(aq)+3Cl—(aq)+6H2O(l),通入 Al3+(aq)+3Cl—(aq)+6H2O(l),通入
HCl气体使溶液中的c(Cl-)增大,平衡向析出固体的方向移动,从而析出AlCl3·6H2O晶体。
本题解析:(1)盐酸可与氧化铝或氧化铁反应,离子方程式为Al2O3+6H+===2Al3++3H2O 或Fe2O3+6H+===2Fe3++3H2O ;
(2)氯化铝和氯化铁水解都生成盐酸,碳酸钙和盐酸反应生成氯化钙和二氧化碳,所以物质X是二氧化碳,水解产生的氢氧化铝和氢氧化钠溶液反应生成可溶性偏铝酸钠,离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O;
(3)根据已知可得,铁离子完全沉淀而铝离子不能沉淀的3.2<pH<4.1,所以若只用CaCO3一种试剂,应先加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3
(4)AlCl3饱和溶液中存在平衡AlCl3·6H2O(s) Al3+(aq)+3Cl—(aq)+6H2O(l),通入HCl气体使溶液中的c(Cl-)增大,抑制氯化铝的溶解,平衡向析出固体的方向移动,从而析出AlCl3·6H2O晶体。 Al3+(aq)+3Cl—(aq)+6H2O(l),通入HCl气体使溶液中的c(Cl-)增大,抑制氯化铝的溶解,平衡向析出固体的方向移动,从而析出AlCl3·6H2O晶体。
考点:考查溶解平衡原理、物质间的反应、除杂,对工艺流程的分析
本题难度:困难
| 