微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
A.NaN3中只含有离子键
B.1molNaN3完全分解最多可以产生33.6LN2
C.NaN3快速分解时,NaN3既是氧化剂,又是还原剂
D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项
参考答案:C
本题解析:NaN3是Na+和N3—构成的离子化合物,N3—中氮元素与氮元素之间还存在共价键,故A选项错误;依题意可得:2NaN3 2Na+3N2↑,由于其中N2与NaN3的系数之比等于物质的量之比,则1mol NaN3完全分解最多可以产生1.5molN2,由于缺少温度和压强,气体摩尔体积不一定是22.4L/mol,则氮气的体积不一定是33.6L,故B选项错误;由于2NaN3
2Na+3N2↑,由于其中N2与NaN3的系数之比等于物质的量之比,则1mol NaN3完全分解最多可以产生1.5molN2,由于缺少温度和压强,气体摩尔体积不一定是22.4L/mol,则氮气的体积不一定是33.6L,故B选项错误;由于2NaN3 2Na+3N2↑中钠元素化合价降低,氮元素化合价升高,则NaN3既是氧化剂又是还原剂,故C选项正确;由于NaN3在高温或剧烈震动能够发生强烈爆炸,因此需要说明安全警示标志,故D选项错误。
2Na+3N2↑中钠元素化合价降低,氮元素化合价升高,则NaN3既是氧化剂又是还原剂,故C选项正确;由于NaN3在高温或剧烈震动能够发生强烈爆炸,因此需要说明安全警示标志,故D选项错误。
本题难度:一般
2、选择题 在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法错误的是
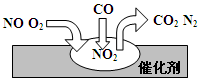
A.NO2是该过程的中间产物
B.汽车尾气的主要污染成分包括CO和NO
C.NO和O2必须在催化剂表面才能反应
D.催化转化总反应为2NO+O2+4CO  4CO2+N2
4CO2+N2
参考答案:C
本题解析:汽油不完全燃烧会产生CO气体,气缸中氮气可可能氧化为NO气体,故汽车尾气的主要污染成分包括CO和NO;
该装置涉及的反应为:2NO+O2=2NO2? 2NO2+4CO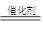 4CO2+N2
4CO2+N2
两式相加得总反应为:2NO+O2+4CO  ?4CO2+N2
?4CO2+N2
可看出,NO2是该过程的中间产物;另外,NO和O2常温下接触即可反应
故答案为C
本题难度:简单
3、填空题 氮元素在自然界中广泛存在,回答以下有关氮及其化合物的相关问题。
(1)氮元素是较活泼的非金属元素,但N2却不活泼,其原因是?。下列用途中,利用了N2不活泼性质的是?
①用于合成氨气?②金属焊接时的保护气?③保护食品?④和氩气混合填充灯泡
⑤以氮气为原料制硝酸
(2)肼(N2H4)常用作火箭燃料,发生的反应是: N2O4(l) + 2N2H4(l)="==3" N2(g)+4H2O(g)
已知N2H4的结构可看做NH3中一个H被-NH2所替代,则N2H4分子中所有原子是否在同一平面内?(填“是”或“否”)。当该反应中有NA个N-H键断裂时,形成的π键有?mol。
(3)某化肥厂用以下流程制备硝酸铵:

上述过程中制硝酸所用去氨的质量占整个流程消耗氨质量的?%。
参考答案:
(1)N2中有氮氮三键(1分)?②③④(2分)
(2)否(1分)? 3/4(1分)
(3)53.9(3分)
本题解析:
(1)N2在高温、高压、催化剂存在条件下,能与某些物质发生反应。例N2和H2→NH3→催化氧化得HNO3,所以排除①⑤;
(2)1mol N2H4中有4mol N—H键,1mol N2中有3mol共价键,其中有2molπ键,故断裂NA个N—H键时,形成的π键为3/4mol。
(3)设制HNO3的NH3的物质的量为1mol,则制得的HNO3的物质的量为1mol ×0.90×0.95=0.855mol,制硝酸所用去氨的质量占整个流程消耗氨质量的的百分比为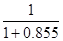 ×100%=53.9%。
×100%=53.9%。
本题难度:一般
4、填空题 2011年3月,日本福岛核电站发生核泄漏,核泄漏的放射性物质中,大量存在一种叫做“碘-131”的放射性元素。传说吃含碘食品或服碘片可以减缓碘-131对人体的影响,有些人就去抢购碘盐、碘片。下表是某食用碘盐包装袋上的部分说明:
配?料
| 食盐、碘酸钾、抗结剂
|
碘含量
| 35±15mg/kg
|
储藏方法
| 密封、避光、防潮
|
食用方法
| 烹饪时,待食品熟后加入碘盐
|
(1)下列说法正确的是?
A.碘酸钾可氧化氯化钠
B.只用淀粉就能检验碘盐中的碘酸钾
C.高温会导致碘的损失
D.该碘盐中碘酸钾含量约为34~84mg/kg
 (2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O? KIO3 + 3H2↑。则阳极材料为?。
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O? KIO3 + 3H2↑。则阳极材料为?。 ?K2SO4+?I2+?H2O
?K2SO4+?I2+?H2O