微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用蒸馏水稀释0.1mol/L的CH3COOH时,始终保持增大趋势的是
A.c(CH3COOH)
B.c(H+)
C.c(OH-)
D.c(CH3COO-)
参考答案:C
本题解析:试题分析:醋酸是弱酸,存在电离平衡CH3COOH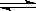 CH3COO-+H+。稀释促进电离,所以氢离子的物质的量是增加的,但氢离子难度是降低的,所以c(OH-)是增大的,其余选项都是降低的,答案选C。
CH3COO-+H+。稀释促进电离,所以氢离子的物质的量是增加的,但氢离子难度是降低的,所以c(OH-)是增大的,其余选项都是降低的,答案选C。
考查弱电解质的电离平衡及外界条件对电离平衡的影响
点评:电离平衡也是一种动态平衡,适用于勒夏特列原理,据此可以进行有关的判断。其次还需要注意物质的量的变化和浓度的变化不一定都是一致的,需要灵活运用。
本题难度:困难
2、选择题 将少量金属钠投入到CuCl2溶液中,主要反应产物是
A.Cu和NaCl
B.H2和NaOH
C.H2、NaCl、Cu(OH)2
D.H2、NaCl、NaOH
参考答案:C
本题解析:金属钠投入到CuCl2溶液中,金属钠先与水反应生成氢氧化钠和氢气,氢氧化钠再与CuCl2溶液反应生成氢氧化铜沉淀,故主要反应产物是H2、NaCl、Cu(OH)2,答案为C.
本题难度:一般
3、选择题 某溶液中若加入NH4SCN溶液出现血红色,则该溶液中有可能大量存在的离子组是
A.Mg2+、Cl-、SO42-、Fe2+
B.Na+、K+、S2-、Cl-
C.K+、Ba2+、SCN-、NO3-
D.A1O2-、Na+、NH4+、SO42-
参考答案:A
本题解析:分析:某溶液中若加入NH4SCN溶液出现血红色,则溶液中存在大量的Fe3+,离子之间不能结合生成沉淀、气体、水,不能结合生成络离子,不能相互促进水解等,则离子能大量共存,以此来解答.
解答:某溶液中若加入NH4SCN溶液出现血红色,则溶液中存在大量的Fe3+,
A.该组离子之间不反应,能大量共存,故A正确;
B.因Fe3+、S2-相互促进水解,则不能大量共存,故B错误;
C.因Fe3+、SCN-结合生成络离子,则不能共存,故C错误;
D.因Fe3+、A1O2-相互促进水解,则不能大量共存,故D错误;
故选A.
点评:本题考查离子共存,明确信息确定溶液中存在铁离子是解答的关键,熟悉复分解反应及水解反应即可解答,题目难度不大.
本题难度:简单
4、选择题 下列各组离子在无色溶液中能同时大量存在的是
A.K+、Al3+、OH-、SO42-
B.Cu2+、Fe3+、Cl-、NO3-
C.Ba2+、Na+、SO42-、NO3-
D.K+、Na+、CO32-、Cl-
参考答案:D
本题解析:分析:根据离子之间不能结合生成水、气体、沉淀等,则离子能大量共存,并注意离子的颜色来解答.
解答:A.因Al3+、OH-能结合生成沉淀,则不能共存,故A错误;
B.该组离子之间不反应,能共存,但Fe3+在水溶液中为黄色,Cu2+为蓝色,与无色不符,故B错误;
C.因Ba2+、SO42-能结合生成沉淀,则不能共存,故C错误;
D.因该组离子之间不反应,则能够共存,且均为无色离子,故D正确;
故选D.
点评:本题考查离子的共存问题,熟悉复分解反应发生的条件及离子的颜色即可解答,难度不大.
本题难度:简单
5、选择题 在一支25 mL的酸式滴定管中盛入0.1 mol·L-1HCl溶液,其液面恰好在5 mL的刻度处,若滴定管中的溶液全部放入烧杯中,然后用0.1 mol·L-1NaOH溶液进行中和,则需NaOH溶液的体积( )
A.大于20 mL
B.小于20 mL
C.等于20 mL
D.等于5 mL
参考答案:A
本题解析:试题分析:因为盐酸液面恰好在5 mL的刻度处时,放出全部液体的体积要大于20 mL。因为HCl+NaOH===NaCl+H2O,所以消耗NaOH溶液的体积大于20 mL,即答案选A。
考点:考查滴定管构造
点评:该题是基础性试题的考查,也是高考中的常见题型。试题基础性强,侧重对学生基础知识的巩固和训练,难度不大。该题的关键是明确滴定管的构造特点。
本题难度:困难