微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
[? ]
金属(粉末状) 物质的量 酸的浓度 酸的体积 反应温度
A. Mg 0.1mol 6mol/L硝酸 10mL 60℃
B. Mg 0.1mol 3mol/L盐酸 10mL 30℃
C. Fe 0.1mol 3mol/L盐酸 10mL 60℃
D. Mg ? 0.1mol 3mol/L盐酸 10mL 60℃
参考答案:D
本题解析:
本题难度:一般
2、填空题 某校化学研究性学习小组学习了化学反应与能量的内容后,对CaCO3与稀盐酸的反应进行了相关探究。他们在室温条件下,将CaCO3块状固体放入1L、1mol?L-1稀盐酸中,记录下了随反应时间的变化生成CO2气体的物质的量情况,绘制成如图曲线。假设溶液的体积变化忽略不计,请分析以下问题:
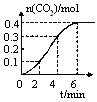
(1)若想加快该反应的速率,可以采取的措施是 、 (答两种)。
(2)0~2min内,用HCl浓度变化表示的平均反应速率为 ,比较0~2min、2~4min、4~6min三个时间段,反应速率最大的是 。
(3)根据定量的数据,定性的描述0~6min内该反应的化学反应速率的变化情况 ;呈现这种变化的原因是 。
(4)根据图像中曲线的变化趋势,第8min时,该反应的反应速率为 。
参考答案:(1)升高温度、将块状固体碾成粉末、适当增加盐酸浓度等(2)0.1mol/(L·min) 2~4 min
(3)反应在0~2 min内较慢,2~4 min内加快,4~6 min内又变慢 ;0~2 min内温度较低,反应慢,随着反应进行,放出的热量使反应体系温度升高,2~4 min内加快,之后,盐酸浓度下降,4~6 min内又变慢
(4)0 mol/(L·min)
本题解析:(1)若想加快该反应的速率,可以采取的措施是升高温度、将块状固体碾成粉末、适当增加盐酸浓度等。(2)反应的方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑由方程式物质间的关系可知,每产生1mol CO2,会消耗2mol的HCl。 图像可以看出:在0~2min内,用HCl浓度变化表示的平均反应速率为(0.2mol÷1L)÷2min=0.1mol/(L·min)。在2~4 min内V(HCl)=(0.4mol÷1L)÷2min=0.2mol/(L·min)。在2~4 min内V(HCl)=(0.2mol÷1L)÷2min=0.1mol/(L·min)。所以在2~4 min内反应速率最大。(3)反应CaCO3+2HCl=CaCl2+H2O+CO2↑是放热反应,在反应开始时,在0~2min内温度较低,反应慢,随着反应进行,放出的热量使反应体系温度升高,2~4 min内加快,之后,由于反应物盐酸浓度下降,因此在4~6 min内又变慢。故反应在0~2 min内较慢,2~4 min内加快,4~6 min内又变慢。(4)根据图像中曲线的变化趋势,结合前边的计算可以看出,第8min时,c(HCl)=0.所以该反应的反应速率为0 mol /(L·min)。
考点:考查影响化学反应速率的因素及CaCO3与HCl反应速率变化的原因的知识。
本题难度:一般
3、选择题 下列说法中正确的是(?)
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.自发反应在恰当条件下才能实现
C.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率
D.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大
参考答案:B
本题解析:A项,化学反应能否自发进行由△H+T△S决定。A项,错误;B项,正确。 催化剂通过影响反应的活化能进而增大单位体积内的活化能分子数,影响化学反应速率,C项,错误。增大反应物浓度,可增大单位体积内活化分子的个数,D项错误。
本题难度:一般
4、填空题 (8分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3h):
T/K
| 303
| 313
| 323
| 353
|
NH3生成量/(10-6mol)
| 4.8
| 5.9
| 6.0
| 2.0
|
相应的热化学方程式如下:
N2(g)+3H2O(l)====2NH3(g)+ O2(g)?ΔH
O2(g)?ΔH =+765.2kJ·mol-1
=+765.2kJ·mol-1
回答下列问题:
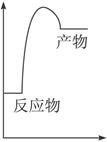
(1)右图是上述反应在无催化剂情况下反应过程中体系能量变化示意图,请在图中画出在有催化剂情况下反应过程中体系能量变化示意图。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:?。
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为 。计算
。计算
①该条件下N2的平衡转化率是?;
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数为?
N2(g)+3H2(g)的平衡常数为? ?。
?。
③若温度不变,减小容器体积,则平衡向---------------------------移动,c(NH3)将--------------------
c(N2)将----------------------(填增大、减小或不变)?
参考答案:(1)画图略。(2分)
(2)升高温度,增大反应物N2的浓度,不断移出生成物(2分)
(3)66 .7%(2分)?0.005(2分)
.7%(2分)?0.005(2分)
本题解析:(1)作图要点:①催化剂 可降低反应的活化能,但这对各反应前后能量变化并不产生任何影响。
可降低反应的活化能,但这对各反应前后能量变化并不产生任何影响。
②该反应为吸热反应,所以反应物的总能量要低于生成物的总能量。
(2)该反应的正反应是吸热反应,升高温度,使化学平衡向正反应方向移动,从而增大NH3的生成量,升高温度也能提高反应速率;增大反应物N2的浓度,加快反应速率,并使化学平衡向右移动;不断移出生成物,使平衡向右移动,增大NH3的生成量。
(3)由三行式法计算可知,起始时,c(N2)=0.3mol·L-1。平衡时,c(N2)=0.1 mol·L-1;?c(H2)=0.2? mol·L-1;c(NH3)=0.4? mol·L-1。
①所以N2的平衡转化率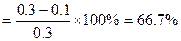 。
。
④?反应2NH3(g)====N2(g)+3H2(g)的平衡常数 。
。
本题难度:一般
5、选择题 一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
[? ]
A.加入少量稀NaOH溶液?
B.加入少量CH3COONa固体
C.加入少量Na2SO4固体?
D.加入少量Na2CO3浓溶液
参考答案:D
本题解析:
本题难度:一般