微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)(Ⅰ)FeCl3的水溶液呈________(填“酸性”、“碱性”或“中性”),原因是__________________________________(用离子方程式表示);实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以___________(填“促进”、“抑制”)其水解;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(Ⅱ)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如右图所示,其读数为 ?mL。

(2)根据下列数据:
滴定次数
| 待测液体积(mL)
| 标准盐酸体积(mL)
|
滴定前读数(mL)
| 滴定后读数(mL)
|
第一次
| 20.00
| 0.50
| 25.40
|
第二次
| 20.00
| 4.00
| 29.10
|
请计算待测烧碱溶液的浓度为?mol/L。
(3)下列实验操作会使实验结果偏高的是??。
A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡
参考答案:(Ⅰ)(1)酸性;Fe3++3H2O Fe(OH)3+3H+;抑制;Fe2O3?
Fe(OH)3+3H+;抑制;Fe2O3?
(Ⅱ)(1)22.60?(2)0.1250?(3)A、B、C、D
本题解析:(Ⅰ)把FeCl3溶液蒸干,水解平衡正向移动,生成Fe(OH)3,再灼烧,Fe2O3分解生成Fe2O3;
(Ⅱ)(1)读数时注意滴定管的刻度特点:小刻度在上,大刻度在下,且读到0.01 mL;
(2)首先要计算两次所用盐酸体积的平均值:
V1=25.40-0.50=24.9mL? V2="29.10-4.00=25.10" mL
则所用盐酸体积的平均值=(24.9+25.10)/2="25.00" mL
由NaOH+HCl=NaCl+H2O,得:C(NaOH)V(NaOH)= C(HCl)V(HCl),则
C(NaOH)=(0.10mol/L×25.00 mL)/20.00 mL="0.1250" mol/L;
(3)利用关系式C(NaOH)= C(HCl)V(HCl)/ V(NaOH)判断,
在代入数据时,C(HCl)=0.10mol/L,V(NaOH)="20.00" mL,所以,所有的不当操作都归结为对盐酸体积的读数;且C(NaOH)与V(HCl)成正比;
锥形瓶用待测液润洗后再注入待测液,n(NaOH)增多,导致V(HCl)增大,故使实验结果偏高;
酸式滴定管未用标准液润洗,将导致C(HCl)减小,消耗V(HCl)增大,故使实验结果偏高;
C中V(HCl)=V2-V1,滴定后仰视读数,导致V2增大,滴定前俯视读数,导致V1减小,则导致V(HCl)增大,故使实验结果偏高;
D将导致V(HCl)增大(多出的盐酸体积=气泡体积),故使实验结果偏高;
本题难度:一般
2、选择题 实验室中制备乙烯的方法是使乙醇脱水,反应可以简单地表示为CH3CH2OH―→CH2=CH2↑+H2O。已知CH2=CH2(g)和C2H5OH(l)的燃烧热分别是1 411.0 kJ·mol-1和1 366.8 kJ·mol-1。则实验室用C2H5OH(l)制备CH2=CH2(g)生成1 mol液态水的ΔH为( )
A.-44.2 kJ·mol-1
B.+44.2 kJ·mol-1
C.-2 777.8 kJ·mol-1
D.+2 777.8 kJ·mol-1
参考答案:B
本题解析:由已知燃烧热可以写出两个热化学方程式:
CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)
ΔH1=-1 411.0 kJ·mol-1 ①
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)
ΔH2=-1 366.8 kJ·mol-1?②
由②-①得:C2H5OH(l)=H2O(l)+CH2=CH2(g)
ΔH=+44.2 kJ·mol-1,B项正确。
本题难度:一般
3、选择题 室温时,把10 mL pH=10的强碱溶液小心地加入到10 mL pH=4的某酸溶液中,在完全反应后的溶液中滴入紫色的石蕊试液时,溶液显红色,则此酸为? (? )
A.一元强酸
B.二元强酸
C.任何强酸
D.弱酸
参考答案:D
本题解析:如果酸为强酸,则两溶液中的H+与OH—恰好中和,溶液呈中性,而实际上混合溶液呈酸性,则只能说明弱酸溶液中存在电离平衡,不断电离出H+,故答案为D,但酸的元数无法确定
本题难度:简单
4、选择题 25℃时pH=14的NaOH溶液与pH=1的H2SO4溶液混合,所得混合液的pH=12,则强碱与强酸的体积比为(? )
A.1:9
B.1:11
C.9:1
D.11:1
参考答案:A
本题解析:考查pH的有关计算。所得混合液的pH=12,说明碱是过量的。溶液中氢离子的浓度是10-12mol/L,则OH-的浓度为0.01mol/L。所以有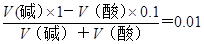 ,解得V(碱)︰V(酸)=1︰9,所以选项A正确。
,解得V(碱)︰V(酸)=1︰9,所以选项A正确。
本题难度:简单
5、选择题 已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-2b kJ·mol-1
B.C2H2(g)+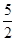 O2(g)===2CO2(g)+H2O(l)ΔH=+2b kJ·mol-1
O2(g)===2CO2(g)+H2O(l)ΔH=+2b kJ·mol-1
C.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-4b kJ·mol-1
D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=+b kJ·mol-1