微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下图中 4种装置①盛 100mLCuSO4,②盛200mL 0.01mol/ LH2SO4,③盛200mL ZnCl2,④盛200mL NaCl饱和溶液工作一段时间后,测得导线上均通过了0.002 mol电子,此时溶液的 pH值由大到小的排列顺序为(不考虑盐的水解和溶液体积变化)?
A.④②③①
B.④③①②
C.④③②①
D.④①③②
</PGN0015B.TXT/PGN>

参考答案:C
本题解析:4个装置①是电解CuSO4,生成H2SO4转移0.02mol电子,生成[H+]0.002/0.1=0.02(mol/L),②装置为原电池,在Cu板上有H2放出,2H++2e=H2↑转移0.002mol电子,则消耗0.002molH+,溶液中剩
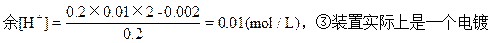
池,pH值不变,④装置为电解NaCl饱和溶液,生成NaOH,pH值最大,所以正确的顺序为:④③②①。
本题难度:一般
2、选择题 蝇类昆虫的雌性信息素可用芥酸(来自白芥)与羧酸X在浓NaOH溶液中进行阳极氧化得到。电解总反应式为
C21H41COOH芥酸+X+4NaOH
参考答案:
本题解析:
本题难度:一般
3、选择题 双隔膜电解池的结构示意简图如图所示,对该装置及其原理判断错误的是(? )

A.c隔膜为阴离子交换膜、d隔膜为阳离子交换膜
B.A溶液为硫酸,B溶液为氢氧化钠
C.a气体为氢气,b气体为氧气
D.该电解反应的总方程式为:2Na2SO4+6H2O 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
参考答案:C
本题解析:该电解装置的实质是用惰性电极电解Na2SO4溶液,左侧为阳极,电极反应为2H2O-4e– = O2↑+4H+,右侧为阴极,电极反应为2H2O-4e– = H2↑+4OH–,所以a气体为氧气,b气体为氢气,故C错误。SO42–向阳极移动,Na+向阴极移动,所以c隔膜为阴离子交换膜,允许SO42–通过,d隔膜为阳离子交换膜,允许Na+通过,故A正确。A溶液为硫酸,B溶液为氢氧化钠溶液,故B正确。由于装置的特殊性,可得产物O2、H2、H2SO4、NaOH,故D正确。答案C。
本题难度:一般
4、选择题 在1 mol·L-1的氢氧化钠溶液中,加入少量下列哪种试剂能使溶液的导电能力明显增强的是(?)
A.H2O
B.HCl
C.氢氧化钠固体
D.碳酸钙固体
参考答案:C
本题解析:溶液导电能力大小与离子浓度和离子所带电荷数目多少有直接关系,所以欲使溶液导电能力增强,需从离子浓度或离子所带电荷数目入手考虑.
A不行,加水对原溶液是稀释,降低了离子浓度.导电能力减弱.
B不行,加盐酸与原溶液反应生成NaCl,完全电离,综合考虑导电能力没有太大变化.
C可以,加入氢氧化钠固体,提高了溶质物质的量浓度,相应提高了离子浓度,导电能力增加.
D不行,碳酸钙不溶于水,也不溶于碱,加入后对溶液体系无影响.所以正确答案选C
本题难度:一般
5、填空题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法之一是电解法。
(1)该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。用Fe作电极的原因为?。
(2)在阴极附近溶液pH升高的原因是(用电极反应解释)?,溶液中同时生成的沉淀还有?。
参考答案:(1)阳极反应2Fe-4e-=2Fe2+,提供还原剂Fe2+
(2)2H++2e-=H2↑ Fe(OH)3
本题解析:明确本题的电解原理:用铁作阳极,产生的亚铁离子将Cr2O72-还原为Cr3+,再转化为氢氧化铬沉淀。
本题难度:一般