微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
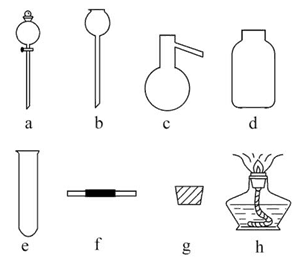
1、选择题 卫生部规定食盐必须加碘,其中的碘以KIO3形式存在。已知:IO3- +I-+H+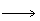 I2+H2O,据此反应,可用试纸和一些生活常见物质进行实验,证明食盐中存在IO3-,可供选用的物质有:①自来水 ②蓝色石蕊试纸 ③淀粉KI试纸 ④淀粉 ⑤食糖 ⑥食醋 ⑦白酒,进行实验时必须使用的是( )
I2+H2O,据此反应,可用试纸和一些生活常见物质进行实验,证明食盐中存在IO3-,可供选用的物质有:①自来水 ②蓝色石蕊试纸 ③淀粉KI试纸 ④淀粉 ⑤食糖 ⑥食醋 ⑦白酒,进行实验时必须使用的是( )
A.①③
B.③⑥
C.②④⑥
D.①②④⑤⑦
参考答案:B
本题解析:
【错解分析】此题为给出信息题,解题的关键是读懂所给信息。
【正解】通过题目信息我们可以得出:要证明IO3-,可让其生成I2,使淀粉变蓝;而要将IO3-转化为I2,需含I-的物质和酸性环境(H+),I-由淀粉KI提供,而H+可由食醋提供,故选B。
本题难度:简单
2、实验题 某化学课外活动小组在实验室设计了如图所示的实验装置,进行“氨的催化氧化”实验。
(1)A处是气体发生装置,A中所用的试剂只能从下列物质中选取:
①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。
若A中制取气体时只用了一种药品,则该药品可以是_________(填选项编号),在只用一种药品制取氨气时,图中空白处所需仪器应为_________ (选填下列仪器编号,固定装置省略)。
(2)该装置补充完整后,仍然存在一定的缺陷,试从安全与环保的角度来考虑,对该装置进行改进:
①_______________________________________________________________;
②_______________________________________________________________。
(3)按照改进后的装置进行实验,请完成以下问题:
①装置B的作用是__________________________________________________;
②写出C中发生反应的化学方程式: ________________________________;
③若A、B处试剂足量,则装置D中可以观察到的实验现象有_________________。
参考答案:(1)②或③? e、f、g、h
(2)①在装置C与D之间增加一个防倒吸装置
②在D后增加一个尾气吸收装置
(3)①吸收CO2和水蒸气,并生成O2
②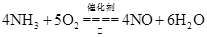
③铜片逐渐减少直至溶解,溶液变蓝色,生成无色气体并在广口瓶上方变成红棕色
本题解析:(1)实验目的是进行“氨的催化氧化”实验,故A、B装置是用来制取NH3和O2的。根据制取NH3只用一种药品和制取NH3的同时必须产生能与Na2O2反应生成O2的物质的要求,选用碳酸铵或碳酸氢铵。选用给固体物质加热所需要的仪器e、f、g、h。
(2)从安全和环保的角度来考虑,应该在C、D之间增加一个防倒吸装置,在D后增加一个尾气吸收装置。因为从C中导出的气体主要是NO2,NO2与水反应生成稀硝酸和NO,易倒吸,且尾气对环境有污染。
本题难度:一般
3、选择题 将一定体积的稀硝酸溶液平均分成两份,一份与足量的铜粉反应收集到气体的体积V1 ,另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到的气体的体积为V2 (V1与V2都是在同一条件下测定)。已测得2 V1=V2,则稀硝酸与稀硫酸的物质的量浓度之比为
A.1:1
B.3:1
C.2:1
D.任意比
参考答案:C
本题解析:设每份硝酸中硝酸的物质的量为a mol
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
第一份硝酸中产生的NO的物质的量为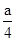 mol(H+全部参加反应,可由其计算)
mol(H+全部参加反应,可由其计算)
第二份硝酸由硫酸补充了部分H+,如果溶液中的NO3-全部被还原,则可得到NO为a mol,不符合题意,故NO3-没有全部参加反应;
设硫酸溶液中硫酸的物质的量为b mol,溶液中H+共(a+2b)mol,可得到NO为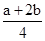 mol
mol
由题意知: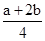 =2×
=2×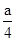 ,即a=2b
,即a=2b
由于两溶液等体积,故硝酸的浓度硫酸的两倍,答案为C
本题难度:一般
4、选择题 近年来,加“碘”食盐中较少使用碘化钾,因其口感苦涩且在贮藏和运输中易变化,目前代之加入是
A.I2
B.KIO
C.NaIO
D.KI O3
O3
参考答案:D
本题解析:略
本题难度:简单
5、计算题 在一只试管中装入NO2和NO混合气体a升(常温常压,下同。不考虑NO2转化为N2O4。),倒扣在水槽中,与水充分反应后剩余气体b升(不含水蒸气),再通入c 升O2,试管内刚好无气体剩余。
(1)b的值为?(用只含c的代数式表示)。
(2)填表。
表达要求
| 只含b的代数式
| 只含c的代数式
|
a的取值范围
| ?
| ?
|
?
(3)写出只含c的代数式的推导过程。
参考答案:(1)4c/3或1.33c(2分)(带单位扣1分)
b<a<3b(2分)(若有取等号扣1分,后同); 4c/3<a<4c或1.33c<a<4c
(3)2分。(说理或推导充分即可。可用方程式推导;也可用得失电子守恒推导。)
本题解析:(1)NO2溶于水生成硝酸和NO,反应的方程式为3NO+H2O=2HNO3+NO,因此bL气体是NO。通入氧气后NO转化为稀硝酸,反应的方程式为
4NO+3O2+2H2O=4HNO3
4? 3
b? c
即4:3=b:c
解得b=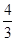 c
c
(2)如果混合气全部是NO2,则根据方程式3NO+H2O=2HNO3+NO可知生成NO的体积是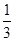 a,b=
a,b=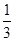 a;如果全部是NO,则生成b=a,所以
a;如果全部是NO,则生成b=a,所以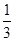 a<b<a,则a的取值范围是b<a<3b;根据(1)中计算可知,b=
a<b<a,则a的取值范围是b<a<3b;根据(1)中计算可知,b=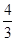 c,所以如果只用含c的代数式表示,则a的取值范围是
c,所以如果只用含c的代数式表示,则a的取值范围是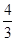 c<a<4c。
c<a<4c。
(3)如果混合气全部是NO2,反应中氮元素的化合价从+4价升高到+5价,氧气中氧元素的化合价从0价降低到-2价,则根据电子得失守恒可知a=4c;如果全部是NO,反应中氮元素的化合价从+2价升高到+5价,氧气中氧元素的化合价从0价降低到-2价,则根据电子得失守恒可知3a=4c,所以a的取值范围是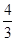 c<a<4c。2、NO与水以及氧气反应的有关计算
c<a<4c。2、NO与水以及氧气反应的有关计算
本题难度:一般