|
高考化学知识点整理《物质的量》高频试题预测(2017年最新版)(四)
2017-08-08 04:28:55
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中Cl-的物质的量浓度和Cl-的物质的量与50 mL 1 mol·L-1的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量都相等的是
A.75 mL 2 mol·L-1 的NH4Cl
B.150 mL 1 mol·L-1 的NaCl
C.50 mL 1.5 mol·L-1 的CaCl2
D.50 mL 3 mol·L-1 的KClO3
参考答案:C
本题解析:50 mL1 mol·L-1的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量分别是1mol/L×3=3mol/L、3mol/L×0.05L=0.15mol。A、75 mL2 mol·L-1 的NH4Cl溶液中Cl-物质的量浓度和Cl-的物质的量分别是2mol/L、2mol/L×0.075L=0.15mol,A不正确;B、150 mL1 mol·L-1 的NaCl溶液中Cl-物质的量浓度和Cl-的物质的量分别是1mol/L、1mol/L×0.15L=0.15mol,B不正确;C、50 mL1.5 mol·L-1 的CaCl2溶液中Cl-物质的量浓度和Cl-的物质的量分别是1.5mol/L×2=3mol/L、3mol/L×0.05L=0.15mol,C正确;D、50 mL3 mol·L-1 的KClO3溶液中不能电离出氯离子,D不正确,答案选C。
本题难度:一般
2、选择题 将5 mL 0.4 mol/LAgNO3溶液与10 mL 0.3 mol/L的BaCl2溶液混合,反应后溶液中离子浓度最大的是
A.Ag+
B.NO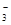
C.Cl-
D.Ba2+
|
参考答案:C
本题解析:发生反应的离子方程式为:Ag+ + Cl- = AgCl↓
1mol 1mol
0.002mol 0.006mol
Cl-过量,反应0.002mol,剩余0.004mol,Ag+反应完,NO3-是0.002mol,Ba2+是0.003mol,Cl-的浓度是最大的,选D。
考点:考查物质的量浓度的相关计算
本题难度:一般
3、简答题 某实验需要80mL、1mol/L的Na2CO3溶液,现通过如下操作配制:
①称量?g?Na2CO3固体放入小烧杯中,加适量蒸馏水溶解.为加快溶解可以使用?玻璃棒搅拌
②待溶液冷却到室温后,小心转入?(填仪器名称)
③继续加蒸馏水至液面至刻度线1~2cm处,改用?(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切
④将容量瓶塞紧,充分摇匀.
⑤用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都转入容量瓶,并轻轻摇匀
(1)操作步骤正确的顺序是?(填序号).
(2)使用容量瓶前必须进行的一项操作是?
(3)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为?.
(4)若取出20mL配好Na2CO3的溶液,加蒸馏水稀释成c(Na+)=0.1mol/L的溶液,则稀释后溶液的体积为?mL
(5)在配制Na2CO3溶液时,下列操作中的?会导致结果偏低
①用拖盘天平称量时砝码放 在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④未冷却到室温就转移到容量瓶中
⑤干净的容量瓶未经干燥就用于配制溶液.
参考答案:没有80mL的容量瓶,所以应选择100mL容量瓶.即所配溶液体积为100mL,
所以需Na2CO3的质量为m=0.1L×1mol?L-1×106g/mol=10.6g.
(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有天平、烧杯、玻璃棒、100mL容量瓶、胶头滴管、药匙.
正确的操作顺序是①②⑤③④.
故答案为:10.6?g;玻璃棒;100ml容量瓶;?胶头滴管;(1)①②⑤③④;
(2)定容后需颠倒摇匀,使用容量瓶前必须进行检查容量瓶是否漏水,故答案为:查漏;
(3)根据c=1000ρωM可知,碳酸钠溶液的质量分数ω=cM1000ρ=1×1061000×1.06=10%,故答案为:10%;
(4)所配溶液c(Na+)=2c(Na2CO3)=2×1mol?L-1=2mol?L-1,
根据稀释定律,稀释前后溶质的物质的量不变,来计算稀释后碳酸钠溶液的体积.
设稀释后碳酸钠溶液的体积为xmL,所以20mL×2mol/L=xmL×0.1mol/L,解得:x=400,所以稀释后碳酸钠溶液的体积是400mL.
故答案为:400mL;
(5)①称量碳酸钠固体时,砝码和物质的位置对调,如未使用游码,对碳酸钠的质量无影响,对所配溶液浓度无影响;
若使用游码,碳酸钠的实际质量减小,所配溶液的浓度偏低.本题碳酸钠质量为10.6?g,使用游码,所配溶液浓度偏低;②向容量瓶中转移溶液时,有溶液洒落在容量瓶外,转移到容量瓶中碳酸钠的质量减小,所配溶液浓度偏低;
③定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高;
④碳酸钠溶解放热,未冷至室温即进行转移、定容,一旦冷却下来会导致体积偏小,所配溶液浓度偏高;
⑤最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响.
故选:①②.
本题解析:
本题难度:一般
4、填空题 (14分)实验室欲配制0.5mol/L的NaOH溶液500ml有以下仪器:
①烧杯 ②100ml量筒 ③100ml容量瓶 ④500ml容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有___________(填代号),还缺少的仪器是_____ _____。该试验中两次用到玻璃棒,其作用分别是_______ ________,_________________。
(2)使用容量瓶前必须进行的一步操作是_____________________。
(3)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为_____________________________________________。(填代号)
(4)在配制过程中,其他操作都正确的,下列操作会引起误差偏高的是__________。
①没有洗涤烧杯和玻璃棒
②未等NaOH溶液冷却至室温就转移到容量中
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视标线 ⑤定容时仰视标线
参考答案:29.(1)①④⑤⑥ ; 胶头滴管 ; 加速溶解 ; 引流
(2)检查是否漏液(水) (3)②①③⑧⑤⑥⑦④ (4)②④
本题解析:(1)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以需要的仪器有托盘天平、烧杯、500ml的容量瓶、胶头滴管、药匙,(1)配制时,必须使用的仪器有①④⑤⑥, 还缺少的仪器是胶头滴管; 该试验中两次用到玻璃棒,其作用分别是, 加速溶解、引流;
(2)因为最后需颠倒摇匀,所以容量瓶在使用前必须检查是否漏水.答案为:检查容量瓶是否漏水;
(3)配制溶液时,正确的操作顺序为②①③⑧⑤⑥⑦④;
(4)①没有洗涤烧杯和玻璃棒,导致溶质质量减少,所配溶液浓度偏低;②未冷却到室温就将溶液转移到容量瓶并定容,温度恢复室温后,会导致溶液体积偏小,溶液浓度偏高;③容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;④定容时俯视刻度线,导致溶液体积偏小,所配溶液浓度偏高;⑤定容时仰视标线,导致溶液体积偏大,所配溶液浓度偏低.选:②④。
考点:考查一定物质的量浓度溶液的配制。
本题难度:一般
5、填空题 (14分)(1)质量都是50g的HCl、NH3、CO2、O2四种气体中,含分子数最少的是?;在同温同压下,密度最小的是?(填分子式)。
(2)在?mL0.2 mol/LNaOH溶液中含1g溶质;配制50mL0.2 mol/LCuSO4溶液,需要CuSO4.5H2O?g。
(3) 标准状况下,33.6LHCI气体溶于水配成1L溶液,则溶液中溶质的物质的量浓度为?mol/L。
(4)质量分数为49%的硫酸溶液,其密度为1.4g/cm3,则其物质的量浓度为?mol/L。
(5)有一种气体的质量是14.2g,在标准状况下的体积是4.48L,则该气体的摩尔质量为?g/mol。
参考答案:(1)CO2;NH3?(2)125 mL; 2.5g? (3) 1.5mol/L?(4)7mol/L?(5)71g/mol。
本题解析:(1)质量相同时,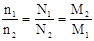 ,CO2的摩尔质量最大,所以分子数最少。 ,CO2的摩尔质量最大,所以分子数最少。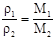 ,NH3的摩尔质量最小,所以密度最小。 ,NH3的摩尔质量最小,所以密度最小。
(2)根据n=cV可得V=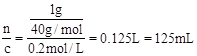 。m=0.05L×0.2mol/L×250g/mol=2.5g。 。m=0.05L×0.2mol/L×250g/mol=2.5g。
(3)c=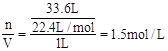 。 。
(4)c=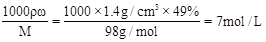 。 。
(5)M=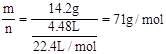 。 。
点评:本题非常基础简单,主要考查物质的量的基本公式计算。
本题难度:一般
|