微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 湿润的蓝色石蕊试纸伸入盛有氯气的集气瓶中,观察到试纸变色的现象为( )
A.变红
B.变白
C.先变红后褪色
D.不变色
参考答案:氯气能与水反应生成盐酸和次氯酸,盐酸和次氯酸都具有酸性,使湿润的蓝色石蕊试纸变红,次氯酸具有强氧化性,有色物质为无色物质,所以现象为:先变红后变白,故选:C.
本题解析:
本题难度:简单
2、简答题 如图,某学习小组利用下列装置探究氯气氨气之间的反应,其中A、F分别为氯气和氨气的发生装置,D为纯净的氯气和氨气的反应装置.
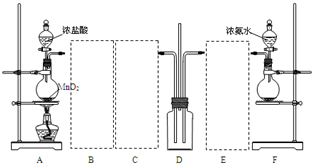
请回答下列问题:
(1)装置F中烧瓶内的固体可选用______
A、氯化铝?B、生石灰?C、五氧化二磷?D、烧碱
(2)实验中所用的浓盐酸的质量分数为36.5%,其密度为1.19?g/cm3,则其物质的量浓度为______(保留两位小数),在标况下需______L(保留两位小数)氯化氢溶于1L水中才可得此浓度的盐酸.
(3)虚线框内应添加必要的除杂装置,请将除杂装置中相应的试剂名称填入下列空格中:B______;C______;E______.
(4)装置D内出现白烟并在容器内壁凝结,鉴定该固体是氯化铵所需要的试剂有:______.
(5)有同学认为D中除了有氯化铵生成外,还应有其他物质生成,你认为他的理由是______.如果D中气体未出现红棕色,也没有白烟产生,则D中发生反应的化学方程式是______.
参考答案:(1)A、C都能够和氨水反应,无法制取氨气;B、D都可以使浓氨水迅速产生氨气,故答案的:BD;
(2)1L溶液的质量为:1.19×1000×1=1190(g),c(HCl)=1190×36.5%36.5÷1=11.9(mol/L),1L溶液中,n(HCl)=11.9mol,标况下,V(HCl)=22.4×11.9=266.56(L),故答案是:11.9mol/L;266.56;
?(3)氯气在饱和食盐水中溶解度较小,故用饱和食盐水出去氯气中混有的氯化氢,所以B为饱和食盐水;浓硫酸不与氯气反应,干燥效果好,故制取氯气常用浓硫酸作干燥剂,故C为浓硫酸;E是干燥氨气的试剂,通常使用碱石灰,故E为碱石灰,
故答案为:饱和食盐水;浓硫酸;碱石灰;
(4)鉴定该固体是氯化铵,需要分别鉴定铵离子和氯离子,铵离子检验方法是:先加入溶液,产生使红色石蕊试纸变蓝的气体,证明铵离子存在;氯离子检验方法是:先滴加硝酸银溶液,产生沉淀,再加入稀硝酸,沉淀不溶解,证明氯离子存在,故答案是:NaOH溶液和湿润的红色石蕊试纸;硝酸银溶液和稀硝酸;
(5)若有氯化铵生成,根据电子守恒,氯气中的氯元素得到电子,化合价降低,一定还有失去电子,化合价升高的元素;由于D中气体未出现红棕色,也没有白烟产生,可以断定氨气中的氮元素应后生成了氮气,发生的反应为2NH3+3Cl2═N2+6HCl,
故答案为:化合价如果只生成氯化铵,化合价只有降而没有升,不符合氧化还原反应得失电子相等的规律;2NH3+3Cl2═N2+6HCl.
本题解析:
本题难度:一般
3、填空题 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
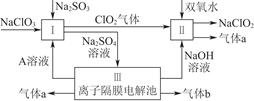
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_____________________________________________________________________________________________________________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:________________________________________________________________________________________________________________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2。用离子方程式解释产生Cl2的原因:________________________________________________________________________
________________________________________________________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量NaClO2,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________(填“相同”“不相同”或“无法判断”)。
参考答案:(1)H—O—O—H Na2SO3
(2)2ClO2 +H2O2+2OH-=2ClO2-+O2↑+2H2O
(3)H2SO4 阳
(4)5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O? ClO2-+3Cl-+4H+=2Cl2↑+2H2O
(5)相同
本题解析:(1)NaClO3中Cl原子化合价为+5价,具有很强的氧化性,而SO32-在酸性条件下具有较强的还原性,故Ⅰ中发生反应的氧化剂是NaClO3,还原剂是Na2SO3;(2)电解Na2SO4溶液相当于电解水,由气体a、b是Na2SO4溶液的电解产物可知为H2和O2,由气体a为反应Ⅱ的产物之一可知其为O2,为H2O2被ClO2氧化得到的产物,故反应Ⅱ的反应物为ClO2、H2O2和NaOH,生成物有NaClO2和O2,根据电子守恒和原子守恒配平即可;(3)电解Na2SO4溶液时OH-在阴极生成,故Na+通过离子隔膜向阴极移动得到产物NaOH溶液,而阳极生成H+,SO42-向阳极移动得到产物A(即H2SO4溶液);(4)①由题意可知反应物为NaClO2和HCl,其中NaClO2中Cl元素的化合价为+3价,既可升高也可降低,故反应为NaClO2自身的氧化还原反应,根据电子守恒可知氧化产物ClO2和还原产物Cl-的物质的量之比为4∶1,根据原子守恒将方程式配平即可;②若产物为Cl2则ClO2-和HCl发生了归中反应,根据电子守恒可知反应的ClO2-和HCl的物质的量之比为3∶1,根据原子守恒将方程式配平即可;(5)变质过程为NaClO2自身的氧化还原反应,无论变质与否,与Fe2+反应时氯元素最终都转化为Cl-,故转移电子数相等。
本题难度:困难
4、选择题 已知钾云母的化学式为K2H4Al6Si6O24。改用氧化物的形式可表示为______________。
参考答案:K2O·3Al2O3·6SiO2·2H2O
本题解析:硅酸盐化学式用氧化物的组成形式来表示的一般方法是:①按顺序写氧化物:活泼金属氧化物不活泼金属氧化物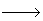 非金属氧化物
非金属氧化物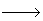 SiO2
SiO2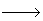 H2O。②氧化物数目用阿拉伯数字在其前面表示。
H2O。②氧化物数目用阿拉伯数字在其前面表示。
本题难度:一般
5、填空题 有一种含碘和氧两种元素的化合物,可称为碘酸碘,其中该化合物中的碘元素呈现两种不同价态+3价和+5价,根据你的现有化学知识水平和综合能力,请给出该化合物的化学式______________________.
参考答案:I4O9
本题解析:因题设条件碘有+3、+5价,又称为碘酸碘,碘酸根为IO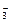 (I为+5价),另+3价应为I3+,所以碘酸碘为I(IO3)3.分子式为:I4O9.
(I为+5价),另+3价应为I3+,所以碘酸碘为I(IO3)3.分子式为:I4O9.
本题难度:一般