微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应中的反应物和生成物有C、CO2、H2SO4、KCr2O7、Cr2(SO4)2、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,所具的性质有
①丁达尔效应②加入饱和(NH4)2SO4溶液产生聚沉③可通过半透膜
(2)请用上述物质填空,配平化学方程式,并标出电子转移的方向和数目(
C+ + H2SO4→ K2SO4+ + Cr2(SO4)3+ H2O
(3)将标准状况下4.48 L产生的气体通入适量的NaOH溶液中充分反应后,溶液中生成盐的质量为19.0g。
(I)若要使生成的盐的质量变为25.2 g,则应继续向溶液中通入该气体 g。
(Ⅱ)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是 或 。
②若只能加入0.10 mol某物质,则加入的物质可以是 或 。
参考答案:
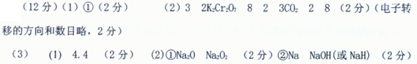
本题解析:略
本题难度:困难
2、选择题 1 mo1Cu2S与2 mol FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、
CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为 (? )
A.4 mo1
B.5 mo1
C.6 mo1
D.7 mo1
参考答案:A
本题解析:2mol+1价的铜离子失去2mol电子变成了+2价,1mol-2价硫离子失去8mol电子变成了+6价,2? mol+2价的铁离子失去2mol电子变成了+3价,所有还原剂一共失去了12mol电子,只有氮元素得到电?子从+5价变成+2价,所以最终生成NO=12/3=4,A正确。
本题难度:一般
3、简答题 (1)2KClO3
2KCl+3O2↑(请用双线桥表示其电子转移情况)
(2)______KMnO4+______HCl(浓)-______KCl+______MnCl2+______Cl2↑+______H2O
(配平并用单线桥表示其电子转移情况)
(3)火药是我国古代四大发明之一.黑火药在爆炸时,反应的化学方程式如下:2KNO3+3C+S=K2S+N2↑+3CO2↑,在此反应中,属于氧化剂的是______,属于氧化产物的是______.(填写化学式)
参考答案:(1)反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12,用双线桥表示其电子转移情况为: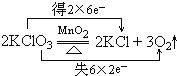 ,
,
故答案为: ;
;
(2)反应中KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,HCl→Cl2↑,Cl元素化合价由-1价升高为0价,共升高2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,结合原子守恒配平后方程式为:2KMnO4+16 HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应中转移电子数目为10,标出电子转移情况为: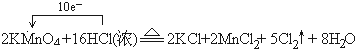 ,
,
故答案为: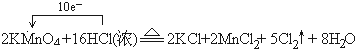 ;
;
(3)反应中N元素化合价由KNO3中+5价降低为N2中0价,S元素化合价由单质硫中0价降低为K2S中-2价,
KNO3、S是氧化剂,C元素由单质碳中的0价升高为CO2中+4价,碳发生氧化反应生成CO2,CO2是氧化产物,
故答案为:KNO3、S;CO2.
本题解析:
本题难度:简单
4、填空题 同位素示踪法是用同位素作为一种标记,制成含有同位素的标记化合物代替相应的
非标记化合物进行化学反应,然后用核探测器随时追踪它在反应产物中的存在形式来确定反应的原理等。
氧化还原反应氧化剂与还原产物、还原剂与氧化产物之间的内在关系也可以利用同位素失踪法进行验证。
(1)H2O2与H2SO4酸化的KMnO4反应,生成K2SO4、MnSO4、H2O和O2,如果H2O2中氧原子是示踪原子(18O),
反应完成后含有示踪原子的物质是________________。
(2)K35ClO3晶体和含有H37Cl的浓盐酸反应生成氯气,已知反应方程式为KClO3+6HCl(浓)= KCl+3Cl2↑+
3H2O,此反应生成氯气的摩尔质量为________________。
(3)某反应体系中共有6种物质,KClO3、KCl、HCl、Cl2、ClO2、H2O,请你设计同位素失踪法确定反应
的方程式并配平:?
参考答案:O2;73.3g.mol-1;2K37ClO3+4HCl= 2KCl+Cl2+237ClO2+2H2O
本题解析:(1)该反应中,H2O2是还原剂,被酸化的KMnO4溶液氧化,化合价升高,生成O2,所以18O存在于O2中。(2)由分析可知,生成的3个Cl2中6个Cl有5个来自于HCl中的37Cl,有1个来自于KClO3中的35Cl,故氯气的分子量为(35+5×37)÷5×2=73.3g,则氯气的摩尔质量为73.3g.mol-1
(3)可以用37Cl跟踪反应,该反应中Cl元素化合价有+5、+4、0、—1四种,显然氯元素最高价和最低
价分别为氧化剂和还原剂,根据同种元素之间发生氧化还原反应化合价“只靠拢、不相交”的原则,如果
用含有同位素37Cl的K37ClO3参加反应,则还原产物为37ClO2,配平方程式得:2K37ClO3+4HCl=
2KCl+Cl2+237ClO2+2H2O。
本题难度:简单
5、填空题 (14分)Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W原子最外层电子数与核外电子总数之比为3∶4,Q、Y的氧化物是导致酸雨的主要物质,X是地壳中含量最高的金属元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。以下问题均有化学用语回答
 (1)Q单质的电子式为_______。
(1)Q单质的电子式为_______。 W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
W、X、Y的离子半径由大到小的顺序为____(用离子符号回答)。
 (2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(2)X和Y组成的化合物放入水中反应的化学方程式是______________________________。
(3)Na2Y溶液中离子浓度由大到小的顺序为____________________________________________。
 (4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(4)ZO在高温下被Q的简单气态氢化物还原为Z单质,写出反应的化学方程式____________。
(5)ZCl2溶液中混有FeCl3杂质时,可加入_____________(填试剂)调节pH=_________,再过滤。已知:Fe(OH)3的Ksp=10-35,化学上认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。
(6)工业上可用高温条件下Z2Y + O2=2Z + YO2来冶炼金属Z,生成1molZ时转移____mol电子。
参考答案: (1)
(1)
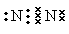 ?(1分)? S2->O2->Al3+(2分)
?(1分)? S2->O2->Al3+(2分) (2)Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑(2分)
(2)Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑(2分)
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) (2分)
 (4)3CuO + 2NH3
(4)3CuO + 2NH3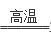 3Cu + N2 + 3H2O (2分)
3Cu + N2 + 3H2O (2分)
(5)CuO(1分) pH=4 (2分)?(6)3 (2分)
本题解析:Q、W、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。Q、Y的氧化物是导致酸雨的主要物质,则Q是氮元素,Y是硫元素。X是地壳中含量最高的金属元素,因此X是铝元素。Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,所以Z是铜元素。W原子最外层电子数与核外电子总数之比为3∶4,且原子序数介于氮元素与铝元素之间,因此W是氧元素,则
 (1)氮气分子中含有氮氮三键,单质的电子式为
(1)氮气分子中含有氮氮三键,单质的电子式为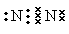 。
。 离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。
离子核外电子层数越多,离子半径越大。在核外电子排布相同的条件下原子序数越小离子半径越大,则W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+。
 (2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑。
(2)X和Y组成的化合物是硫化铝,溶于水与水反应生成氢氧化铝和硫化氢,则放入水中反应的化学方程式是Al2S3 + 6H2O=2Al(OH)3↓+ 3H2S↑。
(3)Na2S溶液中硫离子水解,溶液显碱性,则溶液中离子浓度由大到小的顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。
 (4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3
(4)CuO在高温下被氨气还原为铜单质,而氨气的还原产物是氮气,根据原子守恒还有水生成,则反应的化学方程式为3CuO + 2NH3 3Cu + N2 + 3H2O。
3Cu + N2 + 3H2O。
(5)由于除杂时不能引入新的杂质,则CuCl2溶液中混有FeCl3杂质时,可加入CuO调节pH。当溶液中铁离子浓度为1×10-5mol/L时,此时溶液中氢氧根离子浓度为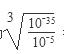 =10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。
=10-10mol/L,则溶液pH对于4,因此最终调解pH=4,再过滤。
(6)根据Cu2S + O2=2Cu +SO2可知,只有硫元素的化合价从-2价升高到+4价,失去6个电子,因此生成1molZ时转移3mol电子。
本题难度:一般