|
高考化学必考知识点《物质的量》高频试题特训(2017年最新版)(十)
2017-08-08 04:30:04
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.0.1(b-2a)mol/L
B.10( 2a-b)mol/L
C.10(b-a)mol/L
D.10(b-2a)mol/L
|
参考答案:D
本题解析:一份中含有的钡离子物质的量为amol,含有氯离子的物质的量为bmol,所以含有钾离子的物质的量为b-2a,钾离子的浓度为(b-2a)÷0.1=10(b-2a)mol/L,选D。
考点:物质的量浓度的计算。
本题难度:一般
2、选择题 质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每毫升质量为q g,物质的量浓度为c.则溶质的分子量(相对分子质量)为( )
A.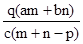
B.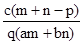
C.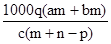
D.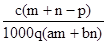
参考答案:C
本题解析:首先求蒸发掉Pg水后溶质质量分数为: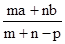 ,据物质的量浓度计算公式:物质的量浓度= ,据物质的量浓度计算公式:物质的量浓度=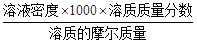 得:溶质的摩尔质量= 得:溶质的摩尔质量=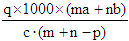 ,故答案C正确,答案选C。 ,故答案C正确,答案选C。
本题难度:一般
3、实验题 仔细阅读给CuSO4·5H2O晶体加热过程中依次发生的如下反应:
CuSO4·5H2O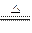 CuSO4+5H2O,CuSO4 CuSO4+5H2O,CuSO4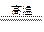 CuO+SO3 CuO+SO3
4CuO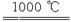 2Cu2O+O2,2SO3 2Cu2O+O2,2SO3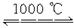 2SO2+O2 2SO2+O2
今取25.0 g CuSO4·5H2O晶体加热,使之均匀、缓慢升温至1000 ℃,并恒温1 h。请完成下列问题:
(1)最终所得固体的颜色为____________,质量为____________ g。
(2)不考虑实验带来的误差,在反应条件下,反应后的除去水后的气态产物的物质的量可能为____________(填写下列选项)。
A.0? B.0.1 mol? C.大于0.1 mol
(3)(2)问中除上述三个选项外,你认为更准确的范围应该是什么?并予以说明。
(4)如果某同学做此实验时,最后固体质量为7.6 g,试通过计算判断该固体物质的组成,其物质的量各是多少?
参考答案:(1)红(或砖红)色? 7.2? (2)C
(3)CuO分解生成0.025 mol O2,SO3分解是可逆反应,故SO3分解反应混合物大于0.1 mol,小于0.15 mol,所以气体的总物质的量大于0.125 mol,小于0.175 mol
(4)剩余固体7.6 g,介于7.2—8.0 g之间,故为CuO和Cu2O混合物。
n(Cu)=n(CuSO4·5H2O)="0.1" mol
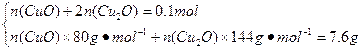
n(CuO)="0.05" mol
n(Cu2O)="0.025" mol
本题解析:由题给信息知,反应最终固体产物是红色的Cu2O,并由Cu元素守恒得m(Cu2O)= 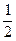 n(CuSO4·5H2O)×M(Cu2O)= n(CuSO4·5H2O)×M(Cu2O)=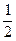 ×0.1 mol×144 g·mol-1="7.2" g。若不考虑误差,0.1 mol CuSO4分解产生SO3和CuO各0.1 mol,CuO又分解生成0.025 mol O2,由于SO3分解是可逆反应,反应混合物大于0.1 mol,小于0.15 mol,所以气体的总物质的量大于0.125 mol,小于0.175 mol。由于0.1 mol CuSO4·5H2O高温分解可得0.1 mol CuO,即质量为8.0 g,CuO继续分解最终可得7.2 g Cu2O。如果最后固体质量为7.6 g,介于7.2 g—8.0 g之间,说明是CuO和Cu2O的混合物,可依据Cu元素守恒列方程组求解其物质的量。 ×0.1 mol×144 g·mol-1="7.2" g。若不考虑误差,0.1 mol CuSO4分解产生SO3和CuO各0.1 mol,CuO又分解生成0.025 mol O2,由于SO3分解是可逆反应,反应混合物大于0.1 mol,小于0.15 mol,所以气体的总物质的量大于0.125 mol,小于0.175 mol。由于0.1 mol CuSO4·5H2O高温分解可得0.1 mol CuO,即质量为8.0 g,CuO继续分解最终可得7.2 g Cu2O。如果最后固体质量为7.6 g,介于7.2 g—8.0 g之间,说明是CuO和Cu2O的混合物,可依据Cu元素守恒列方程组求解其物质的量。
本题难度:简单
4、选择题 配制一定体积,一定物质的量浓度的溶液,下列情况对实验结果产生偏低影响的是
[? ]
A.容量瓶中原有少量蒸馏水? ?
B.洗涤溶解所用的烧杯
C.定容时仰视观察液面? ?
D.定容时俯视观察液面
参考答案:C
本题解析:
本题难度:一般
5、填空题 已知3.01×1023个X气体分子的质量为16g,则X气体的摩尔质量是
参考答案:32g /mol
本题解析:3.01×1023个X气体分子的物质的量为 ,其质量为16g则X气体的摩尔质量 ,其质量为16g则X气体的摩尔质量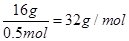
考点:摩尔质量的计算
点评:考查摩尔质量的计算,属于基础题,解题时要抓住物质的量及其推导化式,准确计算。
本题难度:一般
|