微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 mg纯铜粉与足量浓硫酸反应,得到VL二氧化硫气体(标准状况),则被还原的硫酸为( )
A.
mol
B.mol
C.g
D.g
参考答案:n(Cu)=m64mol,V(SO2)=V22.4mol,反应的方程式为Cu+2H2SO4(浓)△.CuSO4+2H2O+SO2↑,
由方程式可知,参加反应的铜的物质的量与生成二氧化硫的物质的量相等,等于被还原的硫酸的物质的量,即被还原的硫酸的物质的量为m64mol或V22.4mol,质量为98V22.4g,
故选AC.
本题解析:
本题难度:简单
2、选择题 某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
[? ]
A.消耗硫酸亚铁的物质的量为n(2-x)
B.处理废水中的Cr2O72-的物质的量为nx/2
C.反应中发生转移的电子数为3nx mol
D.在FeO·FeyCrxO3中,3x=y
参考答案:A
本题解析:
本题难度:一般
3、选择题 铊(Tl)盐与氰化钾(KCN)被列为A级危险品.已知下列反应在一定条件下能够发生:(1)Tl3++2Ag═Tl++2Ag+,(2)Ag++Fe2+═Ag+Fe3+,(3)Fe+2Fe3+═3Fe2+,下列离子氧化性顺序正确的是
A.Tl3+>Fe3+>Ag+
B.Fe3+>Ag+>Tl3+?
C.Ag+>Fe2+>Tl3+?
D.Tl3+>Ag+>Fe2+?
参考答案:D
本题解析:分析:自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,据此判断氧化性强弱.
解答:(1)反应Tl3++2Ag═Tl++2 Ag+中,氧化剂是Tl3+,氧化产物是Ag+,所以氧化性Tl3+>Ag+?,
(2)反应Ag++Fe2+═Ag+Fe3+中,氧化剂是Ag+,氧化产物是Fe3+,所以氧化性Ag+>Fe3+?,
(3)Fe+2Fe3+═3Fe2+中,氧化剂是Fe3+,氧化产物是Fe2+,所以氧化性Fe3+?>Fe2+,?
所以氧化性强弱顺序是Tl3+>Ag+>Fe3+>Fe2+,
故选D.
点评:本题考查氧化性强弱的比较,明确氧化剂、氧化产物是解本题关键,难度不大.
本题难度:困难
4、填空题 X、Y、Z为周期表中前20号主族元素,原子序数递增,X、Y原子的最外层电子数是其电子层数的2倍,Z是人体含量最高的金属元素。
(1)下列含氧酸根化学式书写不正确的是_________________(填序号)。
a.XO3- b.XO32- C.YO32- d.Y2O32- e.X2O42- f.XO42-
(2)Y的最高价含氧酸是重要的化工产品。
①实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的成分(体积分数)如表。

Y在纯氧中燃烧产物里YO3含量比空气中少的原因是_________________________。
②天然ZYO4既可用于制备Y的氧化物又可用于制水泥。ZYO4与X单质在高温下反应,得到两种常见气体。每消耗1molX单质,有4mol电子转移,该反应的化学方程式是:____________________________。
(3)为了测定某水泥样品成分,称取10.0g样品,将其中的Z元素转化为ZX2O4沉淀,将沉淀用稀酸处理得H2X2O4溶液,取该溶液体积的1/100,用KMnO4溶液滴定(氧化产物为XO2,还原产物为Mn2+),结果用去0.0200 mol·L-1。的KMnO4溶液24.00mL。该样品中Z的氧化物的质量分数是______________。
参考答案:(1)af
(2)①纯氧中,O2浓度大,单位时间内放热多,体系温度高,平衡向SO3分解的方向移动
②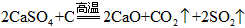
(3)67.2%
本题解析:
本题难度:一般
5、选择题 维生素C具有的性质是
A.难溶于水
B.强还原性
C.强氧化性
D.加热难分解
参考答案:B
本题解析:维生素C具有的性质有易溶于水、受热分解、强还原性等,是一种常用的抗氧化剂,故选B.
本题难度:简单