微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.所有放热反应均是自发反应,也是熵增大的反应
B.向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度小于有AgI的溶解度
C.锌与稀硫酸反应制取氢气,加入少量的硫酸铜粉末会使产生氢气的速度减慢
D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
参考答案:D
本题解析:
A.所有放热反应均是ΔH<0,也是熵增大的反应;?
B.向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgI的溶解度小于有AgCl的溶解度;
C.锌与稀硫酸反应制取氢气,加入少量的硫酸铜粉末,构成原电池,会使产生氢气的速度加快;
本题难度:简单
2、选择题 对于反应A+B=C,下列条件的改变一定能使化学反应速率加快的是( )
A.增加A的物质的量
B.升高体系的温度
C.减少C的物质的量
D.增加体系的压强
参考答案:A、对于反应A+B=C,如果B、C均是气体,而A是固体,增加A的物质的量不会引起速率的变化,故A错误;
B、升高体系的温度,所有化学反应的反应速率均加快,故B正确;
C、对于反应A+B=C,如果B、A均是气体,而C是固体,减少C的物质的量不会引起速率的变化,故C错误;
D、对固体或液体之间的反应,改变压强不会引起化学反应速率的变化,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 下列各条件下发生反应X + Y = XY时,速率最快的是 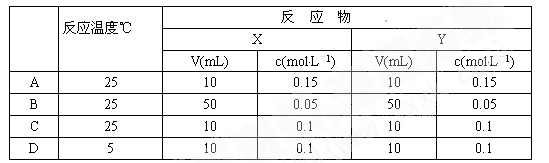
参考答案:B
本题解析:温度越高反应速率越快,D先排除;浓度越高反应速率越快,由于B中X、Y混合后浓度最大,排除A、C;即正确选项为B;
本题难度:一般
4、选择题 下列说法正确的是 (?)
A.活化分子相互碰撞即可发生化学反应
B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
C.某一反应的活化分子百分率是个定值
D.浓度增大使得反应物分子中的活化分子百分率增大
参考答案:B
本题解析:活化分子发生“有效碰撞”可发生化学反应,故A错误;随着外界条件的变化,活化分子百分率会发生变化,如:升温活化分子数增多,则活化分子百分率增大;加催化剂,改变反应路径,降低反应的活化能,则活化分子百分率增大;故C错误;比如开始分子有100个,百分比是20%,那活化分子数是20,现在增加浓度,从100到200,活化分子数从20到40,但是百分比还是20%,故D错误;故选B。
本题难度:一般
5、选择题 已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+ I-→H2O +IO- 慢
H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正确的是
A.反应的速率与I-的浓度有关
B.IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1
D.v(H2O2)=v(H2O)=v(O2)