微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于1mol/L?K2SO4溶液的下列说法正确的是( )
A.溶液中含有1molK2SO4
B.1molK2SO4溶于1L水中
C.溶液中c(K+)=2mol/L
D.1L溶液中含1molK+,1molSO42-
参考答案:A、溶质的物质的量与溶液的浓度、体积有关,为告诉溶液体积,无法计算溶质硫酸钾的物质的量,1L1mol/L?K2SO4溶液,含有1mol硫酸钾,故A错误
B、1molK2SO4溶于水配成1L溶液,浓度为1mol/L,溶液的体积为1L,不是溶剂的体积为1L,故B错误;
C、硫酸钾完全电离,根据硫酸钾的化学式可知,1L1mol/L?K2SO4溶液中钾离子浓度为2mol/L,故C正确;
D、1mol/L?K2SO4溶液中钾离子浓度为2mol/L,硫酸根离子浓度为1mol/L.1L该溶液中含K+的物质的量为1L×2mol/L=2mol,含SO42-的物质的量为1L×1mol/L=1mol,故D错误.
故选:C.
本题解析:
本题难度:一般
2、选择题 1mol/L的Na2SO4溶液是( )
A.溶液中含有1molNa2SO4
B.1升水中加入142gNa2SO4
C.1molNa2SO4溶于1mol水中
D.将322gNa2SO4?10H2O溶于少量水后再稀释成1000mL
参考答案:A、溶液中溶质的物质的量与溶液体积有关,溶液体积未给出,无法计算溶质的物质的量,故A错误;
B、142gNa2SO4的物质的量为1mol,溶于水配成1L溶液,可得1mol/L的Na2SO4溶液,不是指溶剂的体积为1L,故B错误;
C、1molNa2SO4溶于水,配成1L溶液,可得1mol/L的Na2SO4溶液,故C错误;
D、硫酸钠晶体的物质的量为322g322g/mol=1mol,所以硫酸钠的物质的量为1mol,溶液体积为1L,所以硫酸钠溶液浓度为1mol/L,故D正确.
故选:D.
本题解析:
本题难度:简单
3、实验题 实验室用固体烧碱配制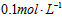 的NaOH溶液500mL,回答下列问题:
的NaOH溶液500mL,回答下列问题:
(1)计算需要固体NaOH的质量_____________g。
(2)有以下仪器和用品:① 烧杯 ② 药匙 ③ 250mL容量瓶 ④ 500mL容量瓶⑤ 玻璃棒 ⑥ 托盘天平配制时,必须使用的仪器或用品有_____________(填序号),还缺少的仪器是__________________。
(3)下列称量NaOH的操作中,正确的是_____________(填序号)
① 把NaOH直接放在托盘天平上称量 ② 把NaOH放在纸上称量 ③ 把NaOH放在小烧杯中上称量
(4)使用容量瓶前必须进行的一步操作是__________________。
(5)配制时,一般分为以下几个步骤: ① 称量 ② 计算 ③ 溶解 ④ 摇匀 ⑤ 转移 ⑥ 洗涤 ⑦ 定容 ⑧ 冷却 ⑨ 振荡。其正确的操作顺序为___________________。
(6)配制过程中,下列操作会引起结果偏高的是______________(填序号)
① 未洗涤烧杯、玻璃棒
② NaOH溶液未冷却至室温就转移到容量瓶
③ 容量瓶不干燥,含有少量蒸馏水
④ 称量NaOH的时间太长
⑤ 定容时俯视刻度
参考答案:(1)2.0g
(2)①②④⑤⑥;胶头滴管
(3)③
(4)检查容量瓶是否漏水
(5)②①③⑧⑤⑥⑨⑦④
(6)②⑤
本题解析:
本题难度:一般
4、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO)>c(OH)>c(H+)
B.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):C(Na+)=c(HRO3-)+2c(RO32-)
C.常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③
D.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液②pH=3的HCl溶液③pH=11的氨水中由水电离出的c(H):①>③>②
参考答案:A、首先书写该溶液的电荷守恒式:c(Na+)+c(H+)=c(CH3COO)+c(OH),然后根据题干c(Na+)>c(CH3COOH),推出醋酸的电离大于CH3COO的水解,从而得出c(H+)>c(OH),所以A错.
B、同样需要书写电荷守恒式:C(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH),溶液呈中性,说明c(H+)=c(OH),从而推出C(Na+)=c(HRO3-)+2c(RO32-),所以B正确.
C、Na2SO3溶液中,因亚硫酸根离子的水解,导致离子一个变俩,所以离子总数最多.所以C错.
D、pH=3的HCl和pH=11的氨水均对水的电离起到抑制作用,并且抑制程度相同,所以③=②,D错.
故选:B
本题解析:
本题难度:简单
5、简答题 在t℃时,a?g某化合物饱和溶液的体积为b?mL,将其蒸干后得到C?g摩尔质量为d?g?mol-1不含结晶水的固体物质,计算:
(1)此物质在t℃时溶解度;
(2)在t℃时,此化合物的饱和溶液中溶质的物质的量浓度.
参考答案:(1)溶液的质量为ag,溶质的质量为Cg,
则该物质的溶解度为S=Cgag-Cg×100g=100ca-Cg,
答:此物质在t℃时溶解度为100ca-Cg;
(2)溶液的体积为bmL,溶质的质量为Cg,
摩尔质量为d?g?mol-1,
则该物质的物质的量浓度为
c=Cgdg?mol-1bml1000mL?L-1=C×1000bd?mol?L-1,
答:此化合物的饱和溶液中溶质的物质的量浓度为C×1000bd?mol?L-1.
本题解析:
本题难度:一般