| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学反应与能量》试题特训(2017年最新版)(十)
参考答案: 本题解析: 本题难度:一般 3、选择题 在无色透明溶液中,能够大量共存的离子组是 参考答案:D 本题解析:分析:溶液无色透明,则有颜色的离子不能大量存在,如离子之间不发生任何反应,则可大量共存. 本题难度:简单 4、选择题 下列变化为放热的化学反应的是( ) |
参考答案:D
本题解析:选项A不是化学变化,不正确;选项B是吸热反应;形成化学键一定是放热的,但相应的化学反应不一定是放热反应,选项C不正确;根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应,答案选D。
本题难度:一般
5、选择题 在298K时,2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是
2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是
A.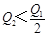
B.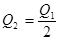
C.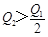
D.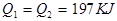
参考答案:A
本题解析:因为二氧化硫与氧气的反应是可能反应,所以反应物不会彻底转化,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1,则Q1<197kJ;向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,若平衡不移动,则放出的热量是Q1的一半,而反应物浓度减少,则平衡逆向进行,所以放出的热量比Q1的一半还少,则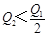 <98.5kJ,答案选A。
<98.5kJ,答案选A。
考点:考查反应物浓度对平衡的影响,可逆反应的理解
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《认识晶体》试题巩.. | |