微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 硫酸铜晶体中结晶水含量的测定实验方案中,下列情况可能造成测试结果偏高的是
①试样中含有加热不挥发的杂质 ②试样中含有加热易挥发的杂质 ③测试前试样已有部分脱水
④实验前坩埚未完全干燥 ⑤晶体加热脱水不完全 ⑥加热时晶体溅出
[? ]
A.①③④
B.②④⑤
C.②④⑥
D.①②③
参考答案:C
本题解析:
本题难度:一般
2、简答题 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4?7H2O)在医药上作补血剂.某课外小组测定该补血剂(每片b克)中铁元素的含量.实验步骤如图所示:
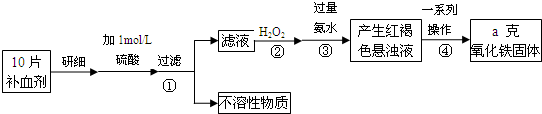
请回答下列问题:
(1)步骤②中H2O2的作用是使Fe2+完全被______(填“氧化”或“还原”)为Fe3+.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含______和______(填化学式).
(3)步骤④中一系列处理的操作步骤为______、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100mL1mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是______.
(5)若实验无损耗,则每片补血剂含铁元素的质量分数为______.
(6)下列操作会导致所测定的铁元素含量偏高的是______
A.步骤③所加氨水量不足B.步骤④洗涤不充分C.步骤④灼烧不充分.
参考答案:(1)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+,故答案为:氧化;
(2)根据反应图示,过量的硫酸能够与氨水反应生成硫酸铵;红褐色的物质是氢氧化铁,故答案为:(NH4)2SO4;Fe(OH)3;
(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,
故答案为:过滤;
(4)精确配制100mL 1mol/L的硫酸溶液,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、100mL容量瓶,所以还需要100mL容量瓶、胶头滴管,
故答案为:100mL容量瓶、胶头滴管;
(5)10片补血剂中氧化铁的物质的量为:a160mol,含有的铁元素质量为:2×a160×56g=7a10g,每片补血剂含铁元素的质量分数为:110×7a10b×100%=7ab%,
故答案为:7ab%;
(6)A、步骤③所加氨水量不足,铁离子沉淀不完全,生成的氢氧化铁减少,氧化铁质量减少,测定结果偏低,故A错误;
B、步骤④洗涤不充分,会导致氧化铁的质量偏大,测得的铁元素质量分数偏大,故B正确;
C、步骤④灼烧不充分,会导致氧化铁固体的质量偏大,铁元素质量分数偏大,故C正确;
故选BC.
本题解析:
本题难度:一般
3、选择题 为探究原电池的形成条件和反应原理,某同学设计了如下实验并记录了现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述稀硫酸中插入铜片,没有看到有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确的是
[? ]
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验④说明该原电池中铜为正极、锌为负极
参考答案:C
本题解析:
本题难度:一般
4、实验题 食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性: >Fe3+>I2;还原性:
>Fe3+>I2;还原性: >I-
>I-
3I2+6OH-==+5I-+3H2O;KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、 Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。
第一份试液中滴加 KSCN溶液后显红色;
第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;
第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_________(用化学式表示);CCl4中显紫红色的物质是___________________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为___________________________、______________________________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式:_____________________________。将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由________________________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的
Fe2+。_______________________________________________
参考答案:(1)①Fe(SCN)3;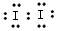 ;②
;② +5I-+6H+==3I2+3H2O;2Fe3++2I-==2Fe2++I2
+5I-+6H+==3I2+3H2O;2Fe3++2I-==2Fe2++I2
(2)4KI+O2+2H2O==2I2+4KOH;否;KI3受热(或潮湿)条件下产生KI和I2,KI氧气氧化,I2易升华
(3)AC
(4)取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+
本题解析:
本题难度:一般
5、选择题 下列有关实验现象的描述不正确的是?
[? ]
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 ?
B.把铁放入稀硫酸中,加几滴氯化铜溶液,产生气泡速率加快 ?
C.溴水加入到淀粉碘化钾溶液中,溶液变蓝? ?
D.乙烯通入到高锰酸钾溶液中,溶液变成紫色
参考答案:D
本题解析:
本题难度:一般