| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《有关氧化还原反应的计算》高频试题特训(2017年最新版)(二)
①催化还原法:催化剂存在时用H2将NO2还原为N2; 已知:2H2(g)+O2(g)=2H2O(g) △H= 参考答案: 本题解析: 本题难度:困难 3、选择题 现将1mo1Cu2S与144克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为 |
参考答案:A
本题解析:144克FeO的物质的量=144g÷72g/mol=2mol,反应中Cu元素化合价由+1价升高为+2价,S 元素化合价由-2升高为+6,Fe元素化合价由+2升高为+3,而N元素化合价由+5降低为+2,根据电子转移守恒:(5-2)×n(NO)=1mol×[2×(2-1)+6-(-2)]+2mol×(3-2),解得n(NO)=4mol,故A项正确。
考点:本题考查氧化还原反应的计算。
本题难度:一般
4、实验题 (16分)亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2 = 2NaNO2
②2NO2 + Na2O2 = 2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2:
(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移
的方向和数目 。
(2)B装置的作用是 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂。
(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论) 。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
参考答案:(1)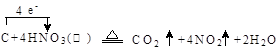
(3分,其中:方程式2分,电子转移方向和数目1分,双线桥表示也给分)
(2)将NO2转化为NO(1分),同时Cu与稀硝酸反应生成NO(1分);或:制取NO。
(3)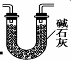 或
或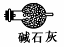
(共2分,其中:装置1分,试剂1分;试剂用生石灰、固体NaOH也可以,合理即给分)
(4)取少量装置C中产物置于试管中,加入适量蒸馏水溶解(1分),(加入稀硫酸酸化,)滴加入1-2滴(少量)酸性KMnO4溶液(1分),若溶液紫色褪去(1分),说明C中产物含有NaNO2。(其他合理也给分)
(5)A、C(4分,漏选扣2分,有错0分)
(6)86.25%或0.8625(2分,有效数字错误扣1分)
本题解析:Ⅰ 、(1)由装置图可知装置A发生反应为浓硝酸与C的反应: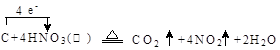 ;(2)B装置的作用是:3NO2+H20=2HNO3+NO,后Cu与稀HNO3反应产生NO,故装置B作用为制取NO;(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,则产生碳酸钠和氢氧化钠的原因是因为NO气体中混有二氧化碳和水蒸气,二者与过氧化钠反应生成碳酸钠和氢氧化钠,故要制备纯净NaNO2应在B、C装置间增加一个装置除去混有的二氧化碳和水蒸气,故应用装有碱石灰的干燥管,装置图为:
;(2)B装置的作用是:3NO2+H20=2HNO3+NO,后Cu与稀HNO3反应产生NO,故装置B作用为制取NO;(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,则产生碳酸钠和氢氧化钠的原因是因为NO气体中混有二氧化碳和水蒸气,二者与过氧化钠反应生成碳酸钠和氢氧化钠,故要制备纯净NaNO2应在B、C装置间增加一个装置除去混有的二氧化碳和水蒸气,故应用装有碱石灰的干燥管,装置图为: 或
或 ;(4)由题中所给信息③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+可知欲检验C中NaNO2的存在,需利用酸性高锰酸钾,可设计实验为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1-2滴酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;Ⅱ、(5)由题中所给数据可知第一组数据明显偏大,根据
;(4)由题中所给信息③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+可知欲检验C中NaNO2的存在,需利用酸性高锰酸钾,可设计实验为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1-2滴酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;Ⅱ、(5)由题中所给数据可知第一组数据明显偏大,根据 可知A项酸式滴定管用蒸馏水洗净后未用标准液润洗,则会导致标准酸性高锰酸钾溶液浓度偏小,则会是所测V(标准)偏大,故会导致所得结果偏大,故A项正确;B项锥形瓶洗净后未干燥,对实验结果无影响,故B项错误;C项滴定终了仰视读数,则会导致V(标准)偏大,故会导致所得结果偏大,故C项正确;D项滴定终了俯视读数,则会导致V(标准)偏小,故会导致结果偏低,故D项错误;本题选AC;(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数=
可知A项酸式滴定管用蒸馏水洗净后未用标准液润洗,则会导致标准酸性高锰酸钾溶液浓度偏小,则会是所测V(标准)偏大,故会导致所得结果偏大,故A项正确;B项锥形瓶洗净后未干燥,对实验结果无影响,故B项错误;C项滴定终了仰视读数,则会导致V(标准)偏大,故会导致所得结果偏大,故C项正确;D项滴定终了俯视读数,则会导致V(标准)偏小,故会导致结果偏低,故D项错误;本题选AC;(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数=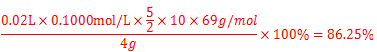 。
。
考点:化学综合实验。
本题难度:困难
5、选择题 下列反应中不属于氧化还原反应的是 (? )
A.2H2O2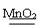 2H2O + O2↑
2H2O + O2↑
B.2Na+Cl2  2NaCl
2NaCl
C.HCl+NaOH=NaCl+H2O
D.3Fe+4H2O(气) Fe3O4 +4H2
Fe3O4 +4H2
参考答案:C
本题解析:略
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《化学平衡的.. | |