微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)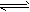 1/2N2(g)+CO2(g);ΔH=-373.2
1/2N2(g)+CO2(g);ΔH=-373.2
kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
[? ]
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
参考答案:B
本题解析:
本题难度:一般
2、填空题 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
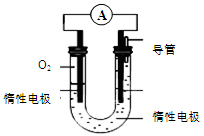
①该电池的能量转化形式为 。
②该电池正极的电极反应为 。
③工作一段时间后,测得溶液的pH减小,则该电池总反应的化学方程式为 。
参考答案:(1)①<(2分) ②80%(2分) 250℃(2分)
(2)CH3OH(l) + O2(g) = CO(g) + 2H2O(l) ΔH1=-442.8kJ/mol(3分)
⑶①化学能转化为电能(2分)
②O2 + 2H2O +4e- = 4OH-(2分)
③2CH3OH + 3O2 + 4OH-= 2CO32-+ 6H2O(3分
本题解析:(1)①由题给数据分析,随着温度的升高,平衡常数减小,平衡向逆向移动,升温平衡向吸热方向移动,该反应正向为放热反应,ΔH1<0;②利用三行式进行计算。按反应II充分反应,达到平衡后,测得c(CO)=0.2mol/L,设转化的CO的物质的量浓度为x,
CO(g)+2H2 (g) CH3OH (g)
CH3OH (g)
起始量(mol/L) 1 3 0
变化量(mol/L) x 2x x
平衡量(mol/L) 0.2 3-2x x
分析知x=0.8mol/L
平衡时各物质的浓度:c(CO)=0.2mol/L,c(H2)=1.4mol/L,c(CH3OH)=0.8mol/L;一氧化碳的转化率=0.8/1×100%=80%,K=0.8/0.2×1.42=2.041,由表格可知温度为250℃;(2)由盖斯定律,①-②得:2CH3OH(l)+2O2(g)
本题难度:困难
3、填空题 . (14分)已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃
| 700
| 900
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
|
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
参考答案:(共14分)
(1)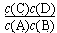 < (每空1分,共2分)
< (每空1分,共2分)
(2)0.022 mol·L-1 0.09mol 80% 80% (每空2分,共8分)
(3) c(2分)
(4) 2.5(2分)
本题解析:(1)平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数表达式K=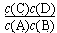 。根据表中数据可知,升高温度,平衡常数减小。这说明升高温度平衡向逆反应方向进行,因此正反应是放热反应,即△H<0。
。根据表中数据可知,升高温度,平衡常数减小。这说明升高温度平衡向逆反应方向进行,因此正反应是放热反应,即△H<0。
(2)6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则消耗A的浓度是0.018mol/L。A的起始浓度是0.20mol÷5L=0.04mol/L,所以此时A的浓度是0.04mol/L-0.018mol/L=0.022mol/L。根据方程式可知,C的物质的量浓度是0.018mol/L,所以C的物质的量是0.018mol/L×5L=0.09mol;设A的转化率是x,则平衡时ABCD的物质的量分别是(0.2-0.2x)mol、(0.8-0.2x)mol、0.2xmol、0.2xmol。根据平衡常数表达式可知0.2x×0.2x=(0.2-0.2x)×(0.8-0.2x),解得x=0.8,即转化率是80%;如果这时向该密闭容器中再充入1 mol氩气,则平衡不移动,转化率不变。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项c正确;反应前后体积不变,因此压强始终是不变的,a不正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,b不正确;d中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此d中的关系始终是成立,不正确,答案选c。
(4)逆反应的平衡常数是正反应平衡常数的倒数,因此该反应的平衡常数是1÷0.4=2.5。
本题难度:一般
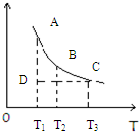
4、选择题 FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+?(aq)+SCN-(aq)? Fe(SCN)2+?(aq);已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T三关系如下图所示,则下列说法正确的是( )
Fe(SCN)2+?(aq);已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T三关系如下图所示,则下列说法正确的是( )
A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)2+(aq)△H>0
B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2
C.反应处于D点时,一定有V正>V逆
D.A点与B点相比,A点的c(Fe3+)大