微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验不能作为判断依据的是
A.钠和镁分别与冷水反应,判断钠和镁金属性强弱
B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱
C.碳酸钠溶液中通入SO2产生气泡,判断碳与硫的非金属性强弱
D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱
参考答案:BC
本题解析:
本题难度:困难
2、选择题 金属的下列性质中,不能用金属晶体结构加以解释的是?
A.易导电
B.易导热
C.有延展性
D.易锈蚀
参考答案:D
本题解析:试题分析:金属晶体是由金属阳离子和自由电子构成的,二者之间存在金属键。由于金属键的存在,使金属易导电、导热、有延展性。而金属的易腐蚀与金属的活泼性相关,答案选D。
考点:考查金属晶体的结构、性质
点评:本题是常识性知识的考查,难度不大。主要是考查学生对基础知识的熟悉掌握程度,不难得分。
本题难度:简单
3、选择题 元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2
参考答案:B
本题解析:试题分析:比较元素的非金属性,可由一是其最高价氧化物的水化物的酸性强弱来判断,二是其氢化物的稳定性,如HClO4的酸性大于H2SO4或稳定性HCl>H2S,可推断出元素的非金属性:Cl>S;而不是氢化物水溶液的酸性
考点:考查元素周期表,元素周期律
本题难度:简单
4、选择题 在无色溶液中,下列离子能大量共存的是
A.Na+、NH4+、NO3-、MnO4-
B.K+、SO42-、Cl-、Mg2+
C.K+、H+、HCO3-、Br-
D.Ba2+、Na+、OH-、CO32-
参考答案:B
本题解析:分析:利用离子之间不能结合生成气体、水、沉淀等来分析离子的共存,并注意MnO4-在水溶液中有颜色来解答.
解答:A、该组离子之间不反应,能大量共存,但MnO4-在水溶液中为紫色,与无色溶液不符合,故A错误;
B、该组离子之间不反应,能大量共存,且均为无色,故B正确;
C、因H+、HCO3-能结合生成水和二氧化碳,则不能大量共存,故C错误;
D、因Ba2+、CO32-能结合生成沉淀,则不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存问题,较简单,学生熟悉复分解反应的条件及常见离子在水中的颜色即可解答.
本题难度:简单
5、选择题 几种短周期元素的原子半径及主要化合价如下表
A.R的氧化物对应的水化物可能具有两性
B.X单质在氧气中燃烧不可能生成XO3
C.离子半径大小:r(M3+)>r(T2-)
D.最高价氧化物对应水化物碱性:L(OH)2>M(OH)3
参考答案:C
本题解析:L、M、X、R、T对应的元素分别为: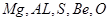 所以
所以
A正确,氢氧化铍具有两性;B正确,S单质燃烧不能生成三氧化硫;C错,离子半径大小关系为:r(T2-)>r(M3+);D正确;镁的金属性比铝强;
本题难度:困难