微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4=3Br2+Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是(?)
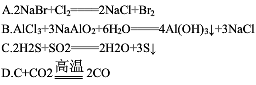
参考答案:C
本题解析:根据题目给定的方程式可知上述反应的特点是同种元素的不同价态的粒子转化为中间价态的粒子,结合选项知只有C项与题干中的原理类似。?
本题难度:一般
2、选择题 下列叙述正确的是
A.既能跟酸反应又能跟碱反应的氧化物称两性氧化物。
B.氨气溶于水主要以NH4+、OH-形式存在。
C.卤素单质中:F2只有氧化性,Cl2易液化,Br2易挥发,I2易升华。
D.NO气体不能用排空气法收集主要原因是NO的相对分子质量与空气的相对分子质量接近。
参考答案:C
本题解析:A不正确,应该是既能跟酸反应生成盐和水,又能跟碱反应反应生成盐和水的氧化物称两性氧化物。氨气溶于水主要以NH3的形式存在,B不正确。NO极易被氧化生成NO2,所以不能用排空气法收集,D不正确,答案选C。
本题难度:简单
3、填空题 (5分)禽流感病毒是一种没有超常抵抗力的病毒。漂白粉是常用的消毒剂,可以将禽流感病毒杀灭。
(1) 漂白粉的有效成分是???(填化学式)。
(2) 工业上制取漂白粉,化学反应方程式为?????。
(3) 漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为?????。
参考答案:(5分)
(1) Ca(ClO)2?(1分);
(2) 2Ca(OH)2 + 2Cl2 ?="=" Ca(ClO)2 + CaCl2 + 2H2O? (2分)
(3) Ca(ClO)2 + CO2 + H2O ="=" CaCO3 ↓+ 2HClO? (2分)
本题解析:(1)漂白粉的有效成分是次氯酸钙化学式为:Ca(ClO)2?
(2)工业上将氯气通入石灰水中制取漂白粉,反应的方程式为
2Ca(OH)2 + 2Cl2 ?="=" Ca(ClO)2 + CaCl2 + 2H2O
(3)漂白粉溶于水中,由于碳酸的酸性比次氯酸强所以次氯酸钙会空气中的二氧化碳反应生成次氯酸,产生漂泊消毒的作用,反应的方程式为
Ca(ClO)2 + CO2 + H2O ="=" CaCO3 ↓+ 2HclO。
本题难度:一般
4、选择题 生产、生活离不开各种化学物质,下列说法不正确的是
[? ]
A.氧化铝可以用来制造耐火坩埚、耐火管和耐高温的实验仪器?
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.工业上常用硅制造光导纤维
参考答案:D
本题解析:
本题难度:简单
5、实验题 某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹)。
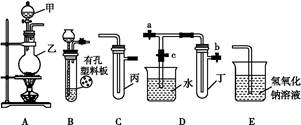
请按要求填空:
(1)利用B装置可制取的气体有 (写出两种即可)。?
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行实验Ⅰ、Ⅱ,实验操作、现象、结论如下:
实验序号
| 实验操作
| 现象
| 结论
|
Ⅰ
| 将氯水滴入品红溶液
| 溶液褪色
| 氯气与水反应的产物有漂白性
|
Ⅱ
| 氯水中加入
NaHCO3粉末
| 有无色气泡产生
| 氯气与水反应的产物具有较强的酸性
|
?
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由 。
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论) ?。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式为 ?。?
②欲用D装置验证NO2与水的反应,其操作步骤如下:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁的操作是 ?。?
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 (气体按标准状况计算)。
参考答案:(1)H2、CO2等
(2)①实验Ⅰ结论不合理,因为未进行干燥的Cl2是否能使品红褪色实验,即使品红褪色的不一定是氯气与水反应的产物,也可能是未反应的氯气。实验Ⅱ结论不合理,制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡 ②在甲、乙、丙中分别装入浓盐酸、MnO2、NaBr溶液;烧瓶中有黄绿色气体生成,丙试管中溶液由无色变为橙色;可证明Cl2的氧化性强于Br2,则Br-的还原性强于Cl-
(3)①Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O
Cu(NO3)2+2NO2↑+2H2O
②a、b c 双手紧握(或微热)试管丁使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁中
③0.045 mol·L-1
本题解析:(1)B装置用于块状不溶于水的固体与液体反应制取气体,故可用锌粒与稀H2SO4制H2,也可用大理石与盐酸制CO2等。
(2)①未反应的Cl2及氯气与水反应的产物都有可能使品红溶液褪色,故结论Ⅰ不合理。A装置制取Cl2使用的浓盐酸具有挥发性,会与NaHCO3反应产生CO2气泡,故实验Ⅱ的结论不合理。②利用氧化性Cl2>Br2即可证明,可在丙中放NaBr溶液,将制得的Cl2通入NaBr溶液,发现溶液由无色变为橙色可证明。
(3)铜与浓HNO3反应放出NO2,收集于试管丁中然后用微热法使NO2与水接触从而使水倒流于丁中。根据1 mol NO2转化成1 mol HNO3可知,所得HNO3的浓度为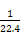 ?mol/L,即0.045 mol/L。
?mol/L,即0.045 mol/L。
本题难度:困难