微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质不能与水反应生成强酸的是( )
A.NO2
B.SO3
C.Cl2
D.CO2
参考答案:A、因NO2与水反应:3NO2+H2O═2HNO3+NO,HNO3是强酸,故A错误;
B、因SO3与水反应:SO3+H2O═H2SO4,H2SO4是强酸,故B错误;
C、因Cl2与水反应:Cl2+H2O?HCl+HClO,HCl是强酸,故C错误;
D、因CO2与水反应:CO2+H2O?H2CO3,H2CO3是弱酸,故D错误;
故选D.
本题解析:
本题难度:一般
2、填空题 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上用电解氯化钠溶液的方式制取氯气,化学反应方程式为
?。
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
?。
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为?。
参考答案:(1) 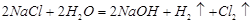
(2)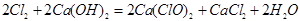
(3)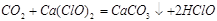
本题解析:(1)电解氯化钠时,应特别注意阴极产生的是氢气,其化学方程式为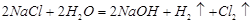 ;
;
(2)注意漂白粉的主要成分是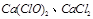 ,其化学方程式为
,其化学方程式为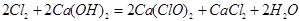 ;
;
(3)此小题写化学方程式不难,但若要写离子方程式则需要注意,次氯酸是弱酸,不能拆。此化学方程式为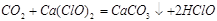 。
。
点评:化学方程式为历年高考的重点,考生在备考过程中应不断积累相关的方程式,特别是书中出现的方程式。
本题难度:一般
3、计算题 将10.000 g氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼烧后残留物的质量为9.813 g.若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为0.721 g.求原混合物中各化合物质量.
参考答案:氯化钠8.700g,溴化钾为:0.500g,氯化钙为:0.800g.
本题解析:设混合物中各物质的质量:NaCl为x g,KBr为y g,CaCl2为z g
x+y+z=10.000 g①
2KBr+Cl2====2KCl+Br2
混合物中KBr转化为KCl,灼烧后溴全部挥发,因此:
x+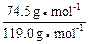 y+z=9.813 g②
y+z=9.813 g②
①式-②式得:(1-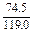 )y=10.000-9.813
)y=10.000-9.813
解得y=0.500 g
残留物溶于水后加入足量碳酸钠溶液,发生如下反应:
CaCl2+Na2CO3====CaCO3↓+2NaCl
从所得CaCO3的质量可以算出CaCl2的质量:
z=0.721 g×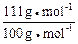 =0.800 g
=0.800 g
氯化钠的质量为:x=10.000-0.500 g-0.800g=8.700g
本题难度:简单
4、填空题 (12 分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的电子排布式为?。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为?。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为?。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为?。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于?。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为? (填序号)。
参考答案:(1)[Ar]3d104s24p5 ?(2) BrI> ICl> Cl2?(3)RbCl?(4)直线形?(5)HF分子间形成氢键?(6)①②③? (每空2分,共12分)
本题解析:(1)溴为四层电子,最外层为七个电子:[Ar]3d104s24p5
(2)分子晶体的沸点一般与分子量大小相关: BrI> ICl> Cl2
(3)随着卤离子的半径增大,所形成卤化物的晶格能越低,故Rb与Cl之间的晶格能大于与I之间的,故A为RbCl
(4)可看作AB2型微粒处理,孤对电子有(7+1-2×1)÷2=5对,两个键对,故价层电子对构型为三角双锥形,微粒构型为直线型
(5)HF分子间形成氢键,易形成聚合分子
(6)含氧酸分子结构中含非羟基氧原子越多,该含氧酸的酸性越强,而HClO4、HIO4的非羟基氧原子为3个,H5IO6为1个;而HClO4、HIO4的酸性相比,氯的非金属性强,其酸性相对较强,故酸性由强到弱的顺序为①②③
本题难度:一般
5、选择题 用MnO2和浓盐酸制取氯气。当4mol氯化氢被氧化,生成的氯气的体积(标况)是(? )
A.22.4L
B.44.8L
C.67.2L
D.89.6L
参考答案:B
本题解析:略
本题难度:简单