|
高中化学知识点讲解《原电池原理》高频考点特训(2017年练习版)(二)
2017-08-08 04:53:18
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
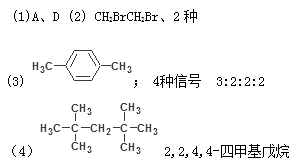
1、填空题 在有机物分子中,不同氢原子的核磁共振谱中给出的信号也不同,根据信号可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为: CH3—CH2—O—CH2—CH3,其核磁共振谱中给出的信号有两个,如图①所示:
图① ?图② ?图②
(1)下列物质中,其核磁共振氢谱中给出的信号只有一个的是?。(填序号)
A.CH3CH3
B.CH3COOH
C. CH3COOCH3
D. CH3OCH3
| (2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如右图②所示,则A的结构简式为?,请预测B的核磁共振氢谱上有?种信号。
(3)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2:3,试确定该烃的结构简式为?;该烃在光照下生成的一氯代物在核磁共振谱中可产生_________种信号,强度比为__________。
(4)在常温下测定相对分子质量为128的某链烃的核磁共振谱,观察到两种类型的H原子给出的信号,其强度之比为9:1,则该烃的结构简式为?,其名称为_______________。
参考答案:
本题解析:略
本题难度:一般
2、填空题 (6分)Ⅰ、已知在101 kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是: 。
Ⅱ、在铜片、锌片和400 mL稀硫酸组成的原电池中,若电路中通过0.2 mol电子,H2SO4恰好反应完毕。试计算:
(1)生成气体的体积(在标准状况下);
(2)原400 mL稀硫酸的物质的量浓度(不考虑溶液的体积变化)。
参考答案:Ⅰ.(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=—2QkJ?mol-1
Ⅱ.(1)正极电极反应式为2H+ + 2e-=H2↑
所以生成的氢气是0.1mol
在标准状况下的体积是0.1mol×22.4L/mol=2.24L
(2)根据氢原子守恒可知原硫酸的物质的量是0.1mol
所以其浓度是0.1mol÷0.4L=0.25mol/L
本题解析:Ⅰ.(1)生成1mol液态水,放出的热量为QkJ,1mol甲烷燃烧生成2mol水,所以放出
的热量是2QkJ,因此热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-2QkJ/mol
Ⅱ.考查原电池的有关计算。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子在正极得到电子,生成氢气,所以该原电池的正极反应式为2H+ + 2e-=H2↑。所以生成的氢气是0.1mol,在标准状况下的体积是2.24L。根据氢原子守恒可知原硫酸的物质的量是0.1mol,所以其浓度是0.1mol÷0.4L=0.25mol/L
本题难度:一般
3、填空题 如图是Cu-Zn原电池的示意图,回答有关问题:
(1)锌极是______极,发生______反应;
(2)铜极是______极,发生______反应;
(3)电池的总反应式是______.
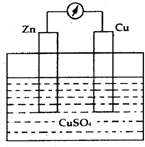
参考答案:(1)锌比铜活泼,为原电池的负极,发生氧化反应,故答案为:负;氧化;
(2)铜为该原电池的正极,发生还原反应,故答案为:正;还原;
(3)正极反应为Cu2++2e-=Cu,负极反应为Zn-2e-=Zn2+,可得总反应为Zn+Cu2+=Zn2++Cu,故答案为:Zn+Cu2+=Zn2++Cu.
本题解析:
本题难度:一般
4、填空题 如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的______棒,乙装置中的______棒.
②乙装置中阳极的电极反应式是:______.
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:______.
②甲装置中碳极的电极反应式是______,乙装置碳极的电极反应属于______(填“氧化反应”或“还原反应”).
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:______.
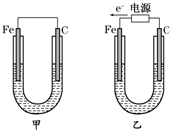
参考答案:(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O电解.Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O电解.Cl2↑+H2↑+2OH-;
②甲中碳为正极,正极上氧气得电子发生还原反应,电极反应为2H2O+O2+4e-═4OH-,乙中碳为阳极,发生氧化反应,故答案为:2H2O+O2+4e-═4OH-;氧化反应;
③碳电极为阳极,阳极上生成氯气,氯气和碘离子发生置换反应生成碘,碘遇淀粉试液变蓝色,故答案为:在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝.
本题解析:
本题难度:简单
5、选择题 在铜-锌-硫酸构成的原电池中,经过一段时间的工作后,下列说法正确的是(?)
A.锌片是负极,铜片上有气泡冒出
B.电流方向是从锌片流向铜片
C.溶液中硫酸的物质的量不变
D.电解液的pH保持不变
参考答案:A
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,溶液中的氢离子得到电子,生成氢气。所以正确的答案是A。
本题难度:一般
|