微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 可逆反应3A(g) 3B(?)+C(?)(正反应吸热)达到化学平衡后,
3B(?)+C(?)(正反应吸热)达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量 ;
②若B、C都不是气体,气体的平均相对分子质量 ;
③若B是气体,C不是气体,气体的平均相对分子质量 ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是 态,C是 态。
(3)如果B为气体,C为固体,取3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L。若使反应从逆反应开始,起始时在容器中加入3molB ,同样条件下,要使平衡时B的浓度仍为2.1mol/L,则C的取值范围应该是 。
参考答案:(1)变小 不变 变小 (2)固体或液体 固体或液体或气体 (3) C(C)>0.3mol
本题解析:(1)可逆反应3A(g) 3B(?)+C(?)(正反应吸热),所以当温度升高,平衡向正反应方向进行,①若B、C都是气体,则正反应方向为分子数增加的反应,故气体的平均相对分子质量增加;②若B、C都不是气体,则气体就只有A,所以气体的平均相对分子质量不变;③若B是气体,C不是气体,则该反应的气体的分子数不变,但是C为非气体,故气态物质的质量比原理减小了,所以气体的平均相对分子质量变小;(2)如果平衡后保持温度不变,将容器体积增加一倍,此时A的浓度必须为原来的50%,但是达到新平衡时A的浓度是原来的60%,说明了反应向逆反应方向移动,所以B为固体或液体,而C可以为 固体或液体或气体;(3)B为气体,C为固体,说明了只要C足量,压强对该反应是没有影响的,3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L,则消耗的A为2.1mol,剩下0.9molA,而使反应从逆反应开始,起始时在容器中加入3molB ,同样条件下,要使平衡时B的浓度仍为2.1mol/L,即B为2.1mol,要生产0.9molA,需要0.3molC,所以C的物质的量要大于0.3mol。
3B(?)+C(?)(正反应吸热),所以当温度升高,平衡向正反应方向进行,①若B、C都是气体,则正反应方向为分子数增加的反应,故气体的平均相对分子质量增加;②若B、C都不是气体,则气体就只有A,所以气体的平均相对分子质量不变;③若B是气体,C不是气体,则该反应的气体的分子数不变,但是C为非气体,故气态物质的质量比原理减小了,所以气体的平均相对分子质量变小;(2)如果平衡后保持温度不变,将容器体积增加一倍,此时A的浓度必须为原来的50%,但是达到新平衡时A的浓度是原来的60%,说明了反应向逆反应方向移动,所以B为固体或液体,而C可以为 固体或液体或气体;(3)B为气体,C为固体,说明了只要C足量,压强对该反应是没有影响的,3molA恒温下在1L容器中充分反应,平衡时测得B的浓度为2.1mol/L,则消耗的A为2.1mol,剩下0.9molA,而使反应从逆反应开始,起始时在容器中加入3molB ,同样条件下,要使平衡时B的浓度仍为2.1mol/L,即B为2.1mol,要生产0.9molA,需要0.3molC,所以C的物质的量要大于0.3mol。
考点:影响化学平衡的因素
点评:本题考查了影响化学平衡的因素,该考点是高考考查的重点和难点,本题综合性好,对学生的分析能量要求比较高,该题有一定的难度。
本题难度:困难
2、填空题 (12分)(I)三氧化二铁和氧化亚铜(Cu2O)都是红色粉末.常用作颜料。已知氧化亚铜溶于稀硫酸生成Cu和CuSO4。某校化学实验小组为了探究由Fe2O3和Cu2O组成的混合物中两者物质的量相对大小,某同学认为只要取少量粉末放入足量稀硫酸中,通过观察现象即可。
(1)上述实验过程中发生的反应有(用离子方程式表示):
①Fe2O3+6H+= 2Fe3++3H2O
② ③
(2)若实验中观察到溶液变为蓝色且有固体剩余,则n(Cu2O) n(Fe2O3)。(填“>”、“<”或“=”)。
(II)分别在密闭容器的两个反应室中进行如下反应:
左反应室:A(g)+2B(g)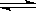 2C(g)
2C(g)
右反应室:2Z(g)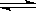 X(g)+Y(g)
X(g)+Y(g)
在反应室之间有无摩擦、可自由滑动的密封板隔断。反应开始和达到平衡时有关物理量的变化如下图所示:
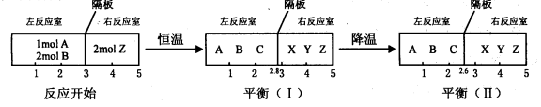
(1)A(g)+2B(g)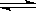 2C(g) 的△H 0(填“>”、“<”或“=”)。
2C(g) 的△H 0(填“>”、“<”或“=”)。
(2)在平衡(I)和平衡(Ⅱ)中,X的体积分数 (填序号)。
a.一定相等 b.一定不相等 c.可能相等
(3)达到平衡(I)时,A的转化率为 。
参考答案:Ⅰ(1)Cu2O+2H+=Cu+Cu2++H2O;Cu+2Fe3+=2Fe2++Cu2+.(2)>
Ⅱ(1) < (2) b (3) 5/11
本题解析:Ⅰ(1)将Fe2O3和Cu2O组成的混合物放入足量稀硫酸中废水反应,氧化铁与硫酸反应生成硫酸铜与水,氧化亚铜与硫酸反应生成铜、硫酸铜与水,生成的铜与硫酸铁反应生成硫酸亚铁、硫酸铜,反应离子方程式依次为Fe2O3+6H+=2Fe3++3H2O,Cu2O+2H+=Cu+Cu2++H2O,Cu+2Fe3+=2Fe2++Cu2+.
答案为:Cu2O+2H+=Cu+Cu2++H2O;Cu+2Fe3+=2Fe2++Cu2+.
(2)若实验中观察到溶液变为蓝色且有固体剩余,说明铜有剩余,溶液中硫酸铁完全转化为硫酸亚铁,由Cu+2Fe3+=2Fe2++Cu2+可知n(Cu)>2n(Fe3+),由Fe2O3+6H+=2Fe3++3H2O可知n(Fe3+)=2n(Fe2O3),由Cu2O+2H+=Cu+Cu2++H2O可知n(Cu)=n(Cu2O),则n(Cu2O)>2n(Fe2O3),答案为:>.
II(1)右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.8处移至2.6处,左室的气体的物质的量减小,降低温度平衡向正反应移动,降低温度平衡向放热反应移动,故该反应正反应为放热反应,即△H<0.答案为:<.
(2)降低温度,右室的平衡一定移动,气体总的物质的量不变,X的含量一定变化,平衡(I)和平衡(Ⅱ)中,X的体积分数一定不相等.选:b.
(3)右室的混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,平衡(I)中左室混合气体总的物质的量为2.8/2.2×2mol=28/11mol,令参加反应的A的物质的量为amol,则:
A(g)+2B(g) 2C(g)物质的量减少△n
2C(g)物质的量减少△n
1 1
amol 3mol-28/11mol=5/11mol,解得a=5/11mol,所以A的转化率为(5÷11)/1=5/11.答案为:5/11。
考点:考查铜、铁及其化合物的性质,影响化学平衡的因素。
本题难度:困难
3、选择题 用来表示可逆反应:2A(g)+B(g) 3C(g)(正反应放热)的正确图象是下图中的 ( )
3C(g)(正反应放热)的正确图象是下图中的 ( )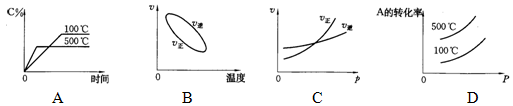
参考答案:A
本题解析:A、温度越高,速率越快,图像陡,升高温度平衡逆向移动,C%减小;
B、温度升高,正逆反应速率均增加;
C、因为是体积不变的反应,增大压强,平衡不移动。
D、压强增大,平衡不移动,A的转化率不变。温度升高,平衡逆向移动,A转化率减小。
本题难度:一般
4、选择题 在一密闭容器中通入A、B两种气体,在一定条件下发生反应2A(g)+B(g)  2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是
2C(g) ΔH<0,当反应达到平衡后,改变一个条件(x),下表中量(y)一定符合下图中曲线的是

[? ]
x?
y?
A
温度
混合气体的平均相对分子质量
B
再通入A
A的百分含量
C
再通入A
B的转化率
D
加入催化剂
A的质量分数
参考答案:C
本题解析:
本题难度:一般
5、选择题 某化学科研小组研究在其他条件不变时,改变其一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量)
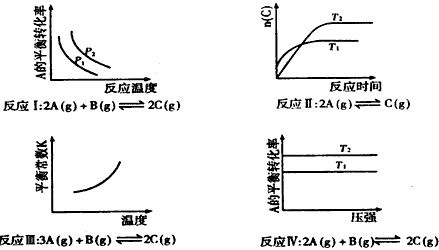
根据以上规律判断,下列结论正确的是
[? ]
A.反应Ⅰ:△H>0,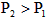
B.反应Ⅱ:△H>0,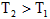
C.反应Ⅲ:△H>0
D.反应Ⅳ:△H<0,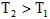
参考答案:C
本题解析:
本题难度:一般