| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学平衡》高频试题巩固(2017年最新版)(八)
参考答案: 本题解析: 本题难度:一般 3、计算题 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
①该反应的正反应为 (填“吸”或“放”)热反应; ②实验2中,平衡常数K= ; ③实验3跟实验2相比,改变的条件可能是 (答一种情况即可); (4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序 。 参考答案: 本题解析: 本题难度:困难 4、选择题 下列有关平衡常数的说法中,正确的是 ?[? ] A.改变条件,反应物的转化率增大,平衡常数也一定增大 B.反应2NO2(g) 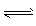 N2O4(g) △H<0,升高温度该反应平衡常数增大 N2O4(g) △H<0,升高温度该反应平衡常数增大 C.对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等 D.平衡常数为 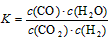 的反应,化学方程式为 的反应,化学方程式为 参考答案:D 本题解析: 本题难度:一般 5、填空题 (共16分) 参考答案:Ⅰ.(1)a > b (2) = a =" b" + c (3)b c (4)d > b 本题解析: 本题难度:一般 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《有机物燃烧.. | |