| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《物质的量》试题预测(2017年最新版)(十)
(3)简要回答下列问题: ①所需浓硫酸的体积为______mL; ②如果实验室有15mL 、20mL、50mL的量筒,应选用_____mL。 参考答案:(1)500ml容量瓶?(2) AEFCBD?(3)① 13.6?② 15 本题解析:(1)根据配制过程可知,还需要500ml容量瓶。 本题难度:一般 4、选择题 同体积、同物质的量浓度的BaCl2溶液可使同体积的Fe2(SO4)3、ZnSO4、K2SO4三种溶液中的SO42—完全沉淀,则三种硫酸盐中金属离子物质的量浓度之比为 |
参考答案:B
本题解析:设三种硫酸盐中金属离子物质的量浓度分别是a、b、c,则根据Ba2++SO42-=BaSO4↓可知,3a=b=c,解得a∶b∶c=2∶3∶6,答案选B。
考点:考查物质的量浓度的有关计算
点评:该题的关键是根据物质化学式找出该物质与所含SO42-的个数之比,然后带入关系式计算即可。
本题难度:一般
5、实验题 28.用18mol/L 浓硫酸配制100 ml? 1.0mol/L 稀硫酸的实验。回答下列问题:
(1)所需浓硫酸的体积是?mL(保留一位小数);
(2)现有下列几种规格的仪器,应选用?
①10mL量筒?②50 mL量筒?③100mL量筒?④100mL容量瓶?⑤250mL容量
(3)下列情况对所配制的稀硫酸浓度有何影响?(填写“偏大”、“偏小”或“无影响”)
①所用的浓硫酸长时间放置在密封不好的容器中?;
②容量瓶用蒸馏水洗涤后没干燥就开始移液?;
③量取浓硫酸时俯视量筒刻度线?;
④定容时俯视容量瓶刻度线?;
参考答案:(1)5.6;(2)①④;(3)①偏小;②无影响;③偏小;④偏大
本题解析:(1)需要浓硫酸的体积是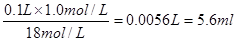
(2)量取时应该选择规格接近的,以减少误差,所以选择①,配制需要100ml容量瓶。
(3)①长时间放置,则浓硫酸的浓度会变稀,结果偏小。
②容量瓶不需要干燥,不影响结果。
③俯视量筒的刻度线,则量取的体积偏小,结果偏小。
④定容时俯视刻度线,溶液体积偏小,结果偏大。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《物质的分类.. | |