微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化合物中只含有离子键的是( )
A.NaOH
B.H2O
C.MgO
D.H2SO4
参考答案:C
本题解析:
本题难度:简单
2、选择题 从电负性的角度来判断下列元素之间易形成共价键的是(? )
A.Na和Cl
B.H和Cl
C.K和F
D.Ca和O
参考答案:B
本题解析:本题主要考查共价键的形成条件,非金属原子之间易形成共价键,活泼的金属原子和活泼的非金属原子之间易形成离子键,结合电负性与元素的性质之间的关系,我们可以得到元素的电负性值相差越大,越易形成离子键,相差越小,越易形成共价键。
本题难度:简单
3、简答题 元素X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大.已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐;Z原子最外层电子数与核外电子总数之比为3:4;M可与Z形成阴、阳离子个数比为1:2的两种化合物,Q原子的最外层电子数与次外电子数之比为3:4,YX3常温下为气体.
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为______,B的化学式是______.
(2)Se是人体必备的微量元素,与Q同一主族.该族二至五周期元素单质分别与H2反应生成1mol?气态氢化物的反应热如下,表示生成1mol哂化氢反应热(△H)的是______?(填字母代号).
A.+99.7kJ?mol-1? B.+29.7kJ?mol-1 C.-20.6kJ?mol-1? D.-241.8kJ?mol-1
(3)X与Z、X与Q均可形成18电子分子甲和乙,写出甲、乙两种分子在水溶液中反应生成Q单质的化学方程式______.X和Y也可形成18电子分子丙,它通常是一种液态火箭燃料.25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,请写出丙完全燃烧的热化学反应方程式______.
(4)X、Y两种元素形成的离子化合物的电子式为______.
参考答案:X、Y、Z、M、Q均为短周期主族元素,且原子序数依次增大.已知元素Y最高价氧化物对应水化物与它的氢化物反应能生成一种盐,则Y是N元素;Z原子最外层电子数与核外电子总数之比为3:4,则Z是O元素;M可与Z形成阴、阳离子个数比为1:2的两种化合物,则M属于第IA族元素,且M的原子序数大于Z,所以M是Na元素,Q原子的最外层电子数与次外电子数之比为3:4,且Q的原子序数大于M,所以Q是S元素,YX3常温下为气体,则Y是H元素,再根据元素化合物的性质分析.
(1)化合物A、B由X、Z、M、Q四种元素中的三种组成的强电解质,说明形成的化合物是强碱或盐,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,若A能抑制水的电离,说明A是碱,B能促进水的电离,说明B是含有弱根离子的盐,所以A是NaOH、B是NaHS,故答案为:NaOH、NaHS;
(2)同主族自上而下非金属性减弱,单质与氢气反应剧烈程度减小,反应热增大(考虑符号),故生成1mol硒化氢(H2Se)反应热应排在第二位,应为+29.7kJ?mol-1,故选B;
(3)X与Z、X与Q均可形成18电子分子甲和乙,则甲、乙分别是H2O2 、H2S,双氧水能氧化硫化氢生成硫单质,同时生成水,反应方程式为:H2O2+H2S=S+2H2O,X和Y也可形成18电子分子丙,其化学式为:N2H4,它通常是一种液态火箭燃料.25℃、常压下,3.2g丙在氧气中完全燃烧放出热量为62.4kJ,则1mol丙燃烧放出的热量是624kJ/mol,所以丙完全燃烧的热化学反应方程式N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol,故答案为:H2O2+H2S=S+2H2O,N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol;
(4)X、Y两种元素形成的离子化合物是氢化铵,氢化铵的电子式为
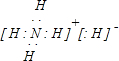
,故答案为:
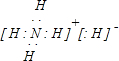
.
本题解析:
本题难度:一般
4、选择题 下列电子式中正确的是
[? ]
A.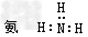
B.
C.
D.
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列有关配合物的论述不合理的是
A.Na[Al(OH)4]和[Ag(NH3)2]OH都是配合物
B.Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6
C.[ZnCl4]2-的空间构型为正四面体形
D.配合物[Cr(H2O)4Br2]Br·2H2O中,中心离子的化合价为+3价,配离子带1个单位的正电荷
参考答案:B
本题解析:B不正确,[Cu(NH3)4]Cl2的配位数是4,其余都是正确的,答案选B。
本题难度:简单