微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 元素X的基态原子最外层电子排布为nsn-1npn+2,则X元素的原子序数为
[? ]
A.9
B.10
C.17
D.18
参考答案:C
本题解析:
本题难度:简单
2、简答题 A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物.回答下列问题:
(1)写出下列各元素的名称:A______?D______
(2)上述五种元素中,第一电离能最小的元素是______,基态原子未成对电子数最多的原子核外电子排布式为______.
(3)已知:BA3DA(g)+A2D(g)=BD2(g)+3A2(g)△H1=+49.0kJ/mol,BA3DA(g)+1/2D2(g)=BD2(g)+2A2(g)△H2=-192.9kJ/mol,试写出:气态BA3DA完全燃烧生成气态A2D的热化学方程式(用推出的元素符号书写);______
(4)对可逆反应3A2(g)+C2(g)?2CA3(g)当反应达到平衡位置时不断改变条件(不改变A2、C2和CA3的量),右图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是______.在一定温度下,若将4amol?A2和2a?mol?C2放入lL的密闭容器中,充分反应后测得C2的转化率为50%,则该反应的平衡常数为______.若此时再向该容器中投入a?mol?A2,a?mol?C2利2a?mol?CA3,判断平衡移动方向______(“正”“逆”或“不移动”).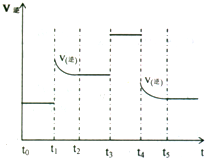
参考答案:A原子半径最小,则A为H元素;B元素原子的最外层电子数是内层电子数的2倍,则B为C元素;C元素原子的电子层数为n,最外层电子数为2n+1,当n为2时,C为N元素,当n为3时,C为Cl元素,根据题意C不能为Cl,否则E就不是短周期元素,所以C为N元素;A、E同主族,所以E为Na元素;A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物,则D为O元素.
(1)由以上推断可知A为H元素,D为O元素,按要求写元素名称为:氢 氧,故答案为:氢? 氧;
(2)根据第一电离能变化规律,周期表中,同周期从左到右,电离能逐渐增大,同主族从上到下,第一电离能逐渐减小,所以这五种元素中钠的第一电离能最小.
H、C、N、O、Na这五种元素的未成对电子依次为:1、2、3、2、1,N元素的未成对电子数最多,电子排布式为:1s22s22p3.故答案为:Na? 1s22s22p3;
(3)把字母换成具体元素得:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ?mol-1
②CH3OH(g)+12O2(g)=CO2(g)+2H2(g);△H=-192.9kJ?mol-1
根据盖斯定律将②×3-①×2可得:CH3OH(g)+32 O2(g)=CO2(g)+2H2O(l)
△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,
故答案为:CH3OH(g)+32 O2(g)=CO2(g)+2H2O(l)△H=-676.7kJ/mol;
(4)从图象可看出,改变条件平衡一直向逆反应方向移动,故t0-t1 NH3含量最高.
? ?3H2+N2=2NH3
起始浓度(mol/L)? 4 a? 2a? 0?
转化浓度(mol/L)?3a? a? 2a
平衡浓度(mol/L)? a? a? 2a
K=(2a)2a×a3=4a2.若此时再向该容器中投入a?mol?A2,a?mol?C2和2a?mol?CA3时,
相当于加压,平衡向体积减少方向即正向移动.故答案为:t0-t1 4a2正.
本题解析:
本题难度:一般
3、选择题 下列关于能层与能级的说法中正确的是
[? ]
A.原子核外电子的每一个能层最多可容纳的电子数为2n2
B.任一能层的能级总是从s能级开始,且能级数不等于该能层序数
C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D.1个原子轨道里最多只能容纳2个电子,但自旋方向相同
参考答案:A
本题解析:
本题难度:一般
4、简答题 氯化铍是用于制有机铍化合物和金属铍的重要原料.
(1)Be原子的基态价电子排布式为______,其元素的第一电离能______B元素(填“>”或“<”或“=”),原因是______.
(2)已知BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为______;?BeCl2中Be原子的杂化轨道类型是______.
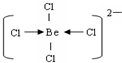
(3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子最外层达到8电子稳定结构,则该阴离子内存在的微粒间的作用力是______,阴离子的结构式为______.
参考答案:(1)Be原子的电子排布式为1s22s2,Be原子的基态价电子排布式为2s2.Be的2s轨道为全充满,稳定状态,体系能量低,第一电离能高于同周期相邻元素.
故答案为:2s2;>;Be的2s轨道全充满,体系能量低.
(2)BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为分子晶体;BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取?sp?杂化方式.
故答案为:分子晶体;?sp.
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,结构式为.
故答案为:共价键、配位键;
.
本题解析:
本题难度:一般
5、选择题 关于原子轨道的说法正确的是
[? ]
A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合形成
C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组新轨道
D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键
参考答案:C
本题解析:
本题难度:一般