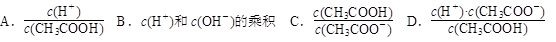|
高中化学知识点总结《弱电解质电离平衡》考点巩固(2017年最新版)(十)
2017-08-08 05:08:54
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (12分)在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
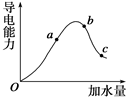
(1)O点为什么不导电 。
(2)a、b、c三点醋酸的电离度最大的是 ___(填“a”、“b”或“c”)。
(3)a、b、c三点的c(H+)由大到小的顺序是____________。
(4)在25℃时,已知c点溶液中pH="5," 则溶液中的c(OH-)= 。
(5)若使c点溶液中的c(CH3COO-)增大,不可以采取下列措施中的________ (填序号)。
A.加热
B.加水
C.加NaOH固体
D.加入锌粒
| (6)随溶液的稀释,下列各项中始终保持增大趋势的是________(填序号)。
参考答案:(1)无自由移动的离子 (2分)(2)c(2分)(3)bac(2分)
(4)10-9mol/L(2分)(5)B(2分)(6)A(2分)
本题解析:(1)冰醋酸是纯醋酸,没有水,不能电离,所以无自由移动的离子。(2)加水越多,醋酸电离程度越大,所以电离度最大的为c。(3)溶液的导电能力越大,溶液中的离子浓度越大,所以溶液中的氢离子浓度的大小顺序为:bac。(4)因为在25℃时水的离子积常数为10-14,所以氢氧根离子浓度=10-14/10-5=10-9mol/L。(5)A、加热电离平衡正向移动,醋酸根浓度增大;B、加水电离程度增大,但醋酸根离子浓度减小;C、加入氢氧化钠固体,电离平衡正向移动,溶液中的醋酸根离子浓度增大;D、加入锌,锌和氢离子反应,是电离平衡正向移动,醋酸根离子浓度增大。所以选B。(6)A、加水稀释电离程度增大,所以氢离子与醋酸分子浓度比值变大;B、氢离子和氢氧根离子浓度的乘积是常数,不变;C、加水稀释,电离程度增大,所以比值减小;D、是醋酸的电离平衡常数,是定值,不变。所以选A。
考点:电离平衡移动。
本题难度:困难
2、填空题 (17分)二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。

(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H="a" kJ·mol-1 2SO3(g) △H="a" kJ·mol-1
在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:
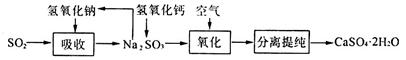
上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为___________________.
参考答案:(1)(2分)a
(2)(6分)-196.6;4;<
(3)(7分)取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸上,待变色后立即对照标准比色卡读数(3分);2[SO32-]+[HSO3-];减小
(4)(2分)Na2SO3+Ca(OH)2=CaSO3↓+2NaOH
本题解析:(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的a。(2)根据题意知,在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,即1molSO2参加反应放出热量98.3 kJ,该反应的热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H=-196.6;4 kJ·mol-1,则a=-196.6;4;T1℃时,反应达平衡时各物质的浓度分别为:c(SO2)="0.5" mol/L 、c(O2)=" 0.25" mol/L、c(SO3)=0.5mol/L,代入平衡常数表达式计算,上述反应的平衡常数K1=4L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,2SO2(g)+O2(g) 2SO3(g) △H=-196.6;4 kJ·mol-1,则a=-196.6;4;T1℃时,反应达平衡时各物质的浓度分别为:c(SO2)="0.5" mol/L 、c(O2)=" 0.25" mol/L、c(SO3)=0.5mol/L,代入平衡常数表达式计算,上述反应的平衡常数K1=4L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,2SO2(g)+O2(g) 2SO3(g) △H=—196.6;4 kJ·mol-1,为放热反应,温度:T2>T1,升高温度平衡逆向移动,平衡常数减小,则K1<K2。(3)用pH试纸测定雨水样品的pH,操作方法为取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸上,待变色后立即对照标准比色卡读数;向二氧化硫水溶液中加氢氧化钠固体使溶液恰好呈中性所得溶液为亚硫酸钠和亚硫酸氢钠的混合液,根据电荷守恒知[H+]+[Na+]=2[SO32-]+[HSO3-] +[OH-],又[H+]=2[SO32-]+[HSO3-],则此中性溶液中离子的浓度间存在的关系式为:[Na+]=2[SO32-]+[HSO3-];将二氧化硫水溶液久置于空气中发生反应2H2SO3+O2 2SO3(g) △H=—196.6;4 kJ·mol-1,为放热反应,温度:T2>T1,升高温度平衡逆向移动,平衡常数减小,则K1<K2。(3)用pH试纸测定雨水样品的pH,操作方法为取一条试纸放在干燥洁净的表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取雨水样品点在试纸上,待变色后立即对照标准比色卡读数;向二氧化硫水溶液中加氢氧化钠固体使溶液恰好呈中性所得溶液为亚硫酸钠和亚硫酸氢钠的混合液,根据电荷守恒知[H+]+[Na+]=2[SO32-]+[HSO3-] +[OH-],又[H+]=2[SO32-]+[HSO3-],则此中性溶液中离子的浓度间存在的关系式为:[Na+]=2[SO32-]+[HSO3-];将二氧化硫水溶液久置于空气中发生反应2H2SO3+O2 2H2SO4,溶液的酸性增强,水的电离程度将减小。(4)根据题给流程判断可以再生循环利用的物质为氢氧化钠,再生的化学方程式为Na2SO3+Ca(OH)2=CaSO3↓+2NaOH。 2H2SO4,溶液的酸性增强,水的电离程度将减小。(4)根据题给流程判断可以再生循环利用的物质为氢氧化钠,再生的化学方程式为Na2SO3+Ca(OH)2=CaSO3↓+2NaOH。
考点:考查二氧化硫的性质,化学实验基本操作,化学平衡,盐类的水解和化学方程式的书写。
本题难度:困难
3、填空题 (12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]
参考答案:
本题解析:
本题难度:一般
4、填空题 常温下,将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
(1)溶液中共有______________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是______________和______________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=______________mol。
参考答案:(1)7?(2)CH3COOH和CH3COO-?(3)0.0060
本题解析:(1)Na+、H+、Cl-、CH3COO-、OH-、H2O、CH3COOH;(3)n(Cl-)+n(CH3COO-) +n(OH-)=n(H+)+n(Na+)(电荷守恒),n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)="0.0060" mol。
本题难度:简单
5、选择题 电离度是描述弱电解质电离程度的物理量,电离度=(已电离的物质的量/原来的总物质的量)×100%。现取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前
CH3COOH的电离度为
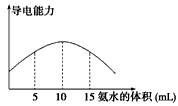
[? ]
A.0.5%
B.1.5%
C.0.1%
D.1%
参考答案:D
本题解析:
本题难度:一般
|