微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩:
⑴在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。与铜相比,其金属活泼性?。(填“强”或“弱”)
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是?。
(3)工业上净化处理铬污染方法之一:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 ?mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为贵重金属之一。
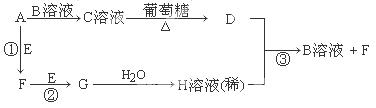
请回答下列问题:
(1)A分子是?分子(填“极性”或“非极性”),C溶液中的阳离子是?(写化学式,不考虑水的电离)。
(2)反应①的化学方程式为?;反应③的离子方程式为?。
参考答案:Ⅰ.(1)强;(2)Cr( OH)3 H+ + CrO2—+ H2O;(3)3.0×10-6;
H+ + CrO2—+ H2O;(3)3.0×10-6;
Ⅱ.(1)极性;[Ag(NH3)2]+;
(2)4NH3+5O2 ?4NO+6H2O;
?4NO+6H2O;
3Ag + 4H+ + NO3—= 3Ag+ + NO↑+ 2H2O
本题解析:Ⅰ(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液,而铜与稀硫酸不反应,说明铬的活泼性强于铜。(2)Cr(OH)3和Al(OH)3类似,由Al(OH)3的酸式电离可知,Cr(OH)3的酸式电离方程式是:Cr(OH)3 H++CrO2-+H2O;(3)电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=4×10?38/2.0×10-13 =2×10-25,故溶液中c(Cr3+)=6.0×l0-31/2×10-25 =3×10-6mol/L;Ⅱ、C溶液与葡萄糖在加热条件下生成金属D,则D为Ag、C为银氨溶液,气体A与溶液B得到银氨溶液,则A为NH3、B为AgNO3,Ag与溶液H反应得到硝酸银与气体F,则H为HNO3,逆推可知G为NO2,F为NO,E为O2。(1)A为NH3,所含化学键均为极性键,空间构型为三角锥形,属于极性分子; C溶液中的阳离子为[Ag(NH3)2]+;(2)反应①的化学方程式为4NH3+5O2
H++CrO2-+H2O;(3)电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=4×10?38/2.0×10-13 =2×10-25,故溶液中c(Cr3+)=6.0×l0-31/2×10-25 =3×10-6mol/L;Ⅱ、C溶液与葡萄糖在加热条件下生成金属D,则D为Ag、C为银氨溶液,气体A与溶液B得到银氨溶液,则A为NH3、B为AgNO3,Ag与溶液H反应得到硝酸银与气体F,则H为HNO3,逆推可知G为NO2,F为NO,E为O2。(1)A为NH3,所含化学键均为极性键,空间构型为三角锥形,属于极性分子; C溶液中的阳离子为[Ag(NH3)2]+;(2)反应①的化学方程式为4NH3+5O2 ?4NO+6H2O;反应③的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。sP的计算、物质的推断及化学方程式的书写。
?4NO+6H2O;反应③的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。sP的计算、物质的推断及化学方程式的书写。
本题难度:一般
2、选择题 下列物质属于电解质的一组是
A.CO2、SO2、HCl
B.H2SO4、K2O、BaSO4
C.H3PO4、H2O、Cu
D.NH3、CH4、NaCl
参考答案:B
本题解析:分析:电解质是在水溶液或熔融状态下能导电的化合物.
解答:A.CO2、SO2属于非电解质,故A错误;
B.H2SO4、K2O、BaSO4是水溶液状态下能导电的化合物,属于电解质,故B正确;
C.铜是单质,不是化合物,所以不是电解质,故C错误;
D.NH3、CH4属于非电解质,故D错误.
故选B.
点评:本题考查学生电解质的概念,难度不大,注意溶于水溶液中或在熔融状态下就能够导电,即是以离子的形式分散在水中,二是该物质是化合物.
本题难度:困难
3、选择题 在CH3COOH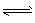 CH3COO-+H+的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是?
CH3COO-+H+的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是?
[? ]
A.加入NaOH固体
B.加浓盐酸
C.加水
D.加热
参考答案:D
本题解析:
本题难度:一般
4、选择题 室温下向10 mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中导电粒子的数目增加,导电性增强
B.醋酸的电离程度增大,c(H+)亦增大
C.再加入10 m L pH="11" NaOH溶液,混合液pH=7
D.溶液中 不变
不变
参考答案:D
本题解析:醋酸溶液中加入水稀释后,醋酸的电离程度增大,溶液中导电粒子的数目增加,但是离子浓度减小,所以导电性减弱;AB错误;C.因为醋酸是弱酸,再加入10 m L pH="11" NaOH溶液,混合液PH<7.C错误;D表示的是醋酸的电力平衡常数,温度不变,电离平衡常数不变,D正确。
本题难度:一般
5、选择题 下列实验,不能说明乙酸是弱电解质的是
A.常温时,测得乙酸钠溶液的pH