微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组气体在常温下能共存且能用向上排空气法收集的是
A.NO和O2
B.HCl和NH3
C.H2和CO
D.SO2和CO2
参考答案:D
本题解析:NO和氧气极易化合生成NO2,氯化氢和氨气极易化合生成氯化铵,均并能共存;氢气的密度小于空气的,应该用向下排空气法收集。CO的密度略小于空气的,且CO有毒,不能用向上排空气法收集,C不正确;D中的气体可以共存,且密度均大于空气的,可以用向上排空气法收集,答案选D。
点评:常见气体的收集方法是:1.排水法,适用于不易溶于水的气体。例如氢气,氧气;2.向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。
本题难度:简单
2、实验题 (15分)某兴趣小组同学共同设置了如图所示的实验装置,既可用于制取气体,
又可用于验证物质的性质。
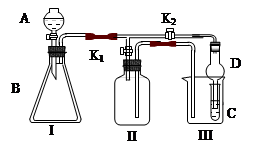
(1)利用I、II装置制取气体(K2闭,K1打开)甲同学认为:利用II装置可以收集H2、NH3等气体,但不能收集O2和NO 等气体,其理由是:__________________________________
____________________________________________________________________
乙同学认为:利用II装置作简单改进,(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是_______________________,利用II装置再作简单改进(不改变仪器装置),还可收集NO2气体,改进方法___________________________。
(2)利用I、III装置验证物质的性质(K2打开,K1关闭),如设计证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加___________,C中加_________,观察到C中的现象是_________________?_?。
(3) 请利用I、III 装置自行设计有机实验,写出实验所用的试剂,简述C中的实验现象及根据此现象所得结论。
A中加___________,B中加___________,C中加____________
现象:____________________,结论:_________________________________________。
参考答案:(1) 氧气的密度比空气大,NO与空气的密度相差不大,同时NO与氧气反应;
将II装置加满水;?将II装置中加难挥发的有机溶剂。?
(2) KMnO4固体;NaBr 溶液;溶液呈橙色。?
(3) A-水或饱和食盐水;B-电石;C-溴水或酸性高锰酸钾溶液;溴水或酸性高锰酸钾溶液褪色;乙炔为不饱和的化合物。? (或A-盐酸;B-大理石;C-苯酚钠溶液;变浑浊;酸性HCl>H2CO3>C6H5OH )
本题解析:(1)根据装置图可知,该装置适用于收集密度小于空气的,且与空气不反应的气体。由于氧气的密度比空气大,NO与空气的密度相差不大,同时NO与氧气反应,所以不能用该装置收集氧气和NO。要在不改变装置的前提下收集氧气和NO2,则将II装置加满水即可。由于NO2能和水反应,因此要收集NO2,只需要将水换成难挥发的有机溶剂即可。
(2)酸性高锰酸钾溶液能氧化浓盐酸生成氯气,所以在B中加入高锰酸钾固体即可。氯气能置换出单质溴,所以在C中放溴化钠溶液即可,溴水显橙色,所以通入氯气后C中溶液显橙色。
(3)根据装置特点可知,可以验证乙酸、碳酸和苯酚的酸性强弱,或者验证乙炔的化学性质。
本题难度:一般
3、选择题 仅用下表提供的仪器和药品,就能达到相应实验目的的是
编号
| 仪器
| 药品
| 实验目的
|
A
| 托盘天平(带砝码)、250mL容量瓶、量筒、烧杯、药匙、玻玻棒
| NaOH固体、蒸馏水
| 配制250mL一定物质的量浓度的NaOH溶液
|
B
| 分液漏斗、锥形瓶、导管及橡皮塞
| 稀硫酸、碳酸钠、硅酸钠溶液
| 证明非金属性;S>C>Si
|
C
| 碱式滴定管、酸式滴定管、胶头滴管、铁架台(带铁夹)、锥形瓶
| 己知浓度的NaOH溶液、待测盐酸、蒸馏水、白纸
| 测定稀盐酸的物质的量浓度
|
D
| 铁架台(带铁夹)、酒精灯、大试管、集气瓶、导管及橡皮塞
| 氯化铵
| 制取氨气
参考答案:B
本题解析:A.配制250mL一定物质的量浓度的NaOH溶液,需要使用的仪器有托盘天平(带砝码)、250mL容量瓶、量筒、烧杯、药匙、玻玻棒、胶头滴管。错误。B。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。根据复分解反应的规律:强酸与弱酸的盐反应制取弱酸。正确。C.测定稀盐酸的物质的量浓度,给定的药品中缺少待测HCl溶液、酸碱指示剂。错误。D.在实验室制取氨气要用氯化铵与氢氧化钙固体,缺少药品氢氧化钙。错误。
本题难度:简单
4、选择题 下列制备气体的实验设计中错误的是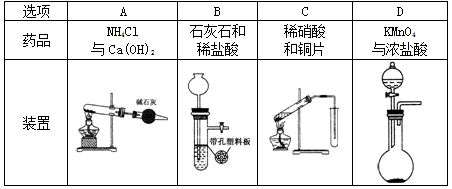
参考答案:C
本题解析:在实验装置中要注意原理的分析,结合实验条件,同时要分析气体是否有毒、有污染等。A项制备氨气一般用固体氯化铵和氢氧化钙混合加热得到,正确;B项是制取氢气装置,正确;C项制取一氧化氮气体,因为一氧化氮气体易与空气中氧气反应结合生产二氧化氮,一般用排水法收集,错误;D项高锰酸钾与浓盐酸反应不需要加热,正确。
点评:Cl2、HCl、CO2、NO2、H2S、SO2等常见气体的制备原理要熟练掌握。本题难度一般。
本题难度:一般
5、实验题 某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:
SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验)。
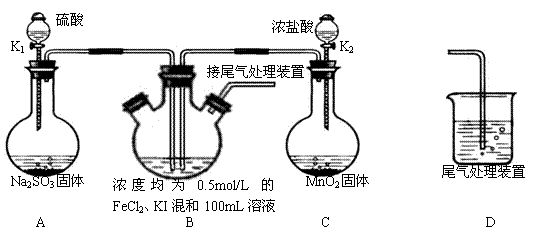
(1)上述实验需要加热的装置是
(2)D中,烧杯盛放的是
(3)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式 ________________
①为验证I-的还原性比Fe2+强,取(3)后B中的少量溶液于试管中,应再往试管中滴入 ________ 溶液,现象是
②在(3)后,为了比较SO2和I-的还原性强弱,接下来的操作是
A.关闭K2开K1
B.关闭K1打开K2
C.同时打开K1和K2
(4)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为 ?________?
参考答案:(13分 除第一空一分外其余每空二分)(1)C?(2)NaOH溶液
(3)2I-+ Cl2 =I2 + 2Cl-?淀粉溶液 溶液呈蓝色(或K(SCN)3溶液 溶液呈血红色)? A
(4)0.56L
本题解析:(1)实验室制备氯气需要加热,则需要加热的装置是C装置,答案选C。
(2)由于SO2和氯气都是大气污染物,需要尾气处理,所以D中烧杯盛放的氢氧化钠溶液。
(3)①由于碘离子的还原性强于亚铁离子,则氯气首先氧化的是碘离子,反应的离子方程式是2I-+ Cl2 =I2 + 2Cl- 。检验单质碘碘生成可以用淀粉溶液,实验现象是溶液呈蓝色。
②要比较SO2和I-的还原性强弱,则需要通过A装置制备SO2,所以正确的操作是关闭K2开K1,答案选A。
(4)碘离子和亚铁离子碘物质的量均是0.1L×0.5mol/L=0.05mol,通入SO2后,SO2分别将铁离子和单质碘还原为亚铁离子和碘离子,但由于铁离子的氧化性强于单质碘的,所以当Fe3+全部转化为Fe2+时,根据电子得失守恒可知,需要SO2的物质的量是0.05mol÷2=0.025mol,在标准状况下的体积是0.025mol×22.4L/mol=0.56L。2的制备、氧化还原反应的有关判断和计算、化学实验基本操作
点评:本题高考中的常见题型,属于中等难度的试题。试题基础性强,贴近高考,在注重对学生基础知识巩固和训练对同时,侧重对学生能力的培养,有利于培养学生规范严谨的实验设计能力和动手操作能力,也有助于提升学生的学科素养。
本题难度:一般
|