微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是( )
A.氯化铁溶液中加入过量氨水Fe3++3OH-=Fe(OH)3↓
B.钠与水的反应 Na+2H2O=Na++2OH-+H2↑
C.碳酸钙溶于稀盐酸中CO32-+2H+=H2O+CO2↑
D.氧化镁与稀盐酸混合:MgO+2H+=Mg2++H2O
参考答案:A、氨水属于弱碱,不能拆成离子形式,应改为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,故A错误;
B、离子反应遵循电荷守恒,应改为:2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C、碳酸钙是难溶于水的盐类,不能拆成离子形式,应改为:CaCO3+2H+=CO2↑+H2O+Ca2+,故C错误;
D、氧化镁与稀盐酸混合生成对应的盐氯化镁和水:MgO+2H+=Mg2++H2O,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 下列反应的离子方程式,正确的是(?)
A. 溶液与
溶液与 溶液混合:
溶液混合: ↓
↓
B.醋酸除水垢: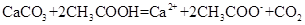 ↑+
↑+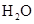
C.漂白粉溶液中通入过量的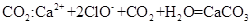 ↓+
↓+
D.少量金属钠放入冷水中: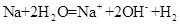 ↑
↑
参考答案:B
本题解析:A、NaHSO4溶液与Ba(OH)2溶液混合,除了生成BaSO4沉淀外,还生成H2O,错误;B、CH3COOH与CaCO3反应生成(CH3COO)2Ca、CO2、H2O,(CH3COO)2Ca为强电解质,拆为离子可得离子方程式,正确;C、过量的CO2反应生成HCO3?,错误;D、没有配平,电荷不守恒,错误。
本题难度:一般
3、选择题 下列离子方程式中,书写正确的是( )
A.NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑
B.盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑
C.AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓
D.铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+
参考答案:A、NaHCO3溶液中加入盐酸的反应为:HCO3-+H+═H2O+CO2↑,故A错误:
B、碳酸钙是难溶物,不能拆成离子形式,应为:CaCO3+2H+=Ca2++CO2↑+H2O,故B错误;
C、AlCl3溶液中加入过量氨水发生反应生成氢氧化铝,氨水属于弱碱,即Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故C错误;
D、铜片加入三氯化铁溶液中的反应为:Cu+2Fe3+═2Fe2++Cu2+,故D正确.
故选D.
本题解析:
本题难度:一般
4、选择题 (1)铜粉放入稀H2SO4中,加热后无明显现象,当加入KNO3?后,铜粉质量减小,溶液变蓝,同时气体逸出,该反应的离子方程式为 ?。(2)在含Cu+的酶的活化中心内,亚硝酸根离子(NO2-)可转化为NO,写出Cu+与亚硝酸根离子在酸性水溶液中反应的离子方程式?。
参考答案:方程式、离子方程式评分标准:
1.未配平或配平错误不得分;
2.配平正确,其它不全,扣1分 (如条件不全,缺“↑”等):
(6分)(1)3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑(3分)
(2)Cu++2H++NO2-=Cu2++H2O+NO↑(3分)
本题解析:(1)铜是不活泼的金属,与稀硫酸不反应。由于在酸性条件下NO3-具有强氧化性,能和铜发生氧化还原反应生成硝酸铜、和水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。
(2)在含Cu+的酶的活化中心内,亚硝酸根离子(NO2-)可转化为NO,这说明反应中NO2-得到电子,做氧化剂,因此Cu+失去电子,被氧化生成Cu2+,所以反应的离子方程式为Cu++2H++NO2-=Cu2++H2O+NO↑。
本题难度:一般
5、选择题 下列离子方程式书写正确的是
[? ]
A.Fe3O4溶于稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.铝片溶于NaOH溶液:Al+2OH-=AlO2-+H2↑
C.向苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
D.向含1mol碘化亚铁的溶液中通入标准状况下22.4L氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
参考答案:C
本题解析:
本题难度:一般