微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关海水综合利用的说法正确的是?
[? ]
A.从海水中可以得到NaCl,NaCl是制造化肥的原料
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有碘元素,只需将海水中的碘升华就可以得到碘单质
D.利用潮汐发电是将化学能转化为电能
参考答案:A
本题解析:
本题难度:简单
2、填空题 海水中溶解了大量的气体物质和各种盐类。人类在陆地上发现的100多种元素中,有80多种可以在海水中找到。海洋是一个远未被完全开发的、巨大的化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,其技术和工艺比较完备,但大量使用燃煤,能耗多、排污量大。为克服 蒸馏法淡化海水的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议:____。
(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式:____。
(3)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
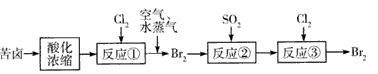
a.反应②的离子方程式为____,
b.从反应③后的四氯化碳溶液中分离出单质溴的方法是____。
(4)苦卤中含有NaCl、MgCl2、KCl、MgSO4。如何测定苦卤中MgCl2的含量:___ (用简要的文字说明)。
参考答案:(1)充分利用潮汐能、风能、太阳能等海边富有的洁净能源
(2) CH2 ==CHCOONa
(3)SO2+Br2+2H2O==4H++2Br-+SO42- ;蒸馏
(4)先用足量BaCl2溶液沉淀硫酸根离子,求出硫酸根离子的总量,并求出MgSO4的量,然后用足量NaOH溶液沉淀Mg2+,求出总的Mg2+的量,减去MgSO4中的Mg2+的量得到MgCl2的量
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是
[? ]
①海水中含有大量的Br-,所以从海水中提取溴一般要经历浓缩和提取两个步骤
②铝是一种比较活泼的金属,所以铝合金制品易被腐蚀
③在煤中加入适量的生石灰,可以减少煤燃烧时二氧化硫的排放
④制造玻璃的主要原料是纯碱、石灰石和石英
A.②③?
B.②④
C.①③?
D.③④
参考答案:D
本题解析:
本题难度:简单
4、选择题 随着世界人口的急剧增长和工业的快速发展,淡水供应危机日益成为世界关注的焦点,海水约占地球现有总水量的97%,海水淡化问题已成为科学家的主要研究方向,若实行海水淡化来供应饮用水,下列方法在原理上完全不可行的是
[? ]
A.加入明矾,使海水的盐份沉淀并淡化
B.利用太阳能,将海水蒸馏淡化
C.将海水通过离子交换树脂,以除去所含的盐分
D.利用半透膜,采用反渗透法而使海水淡化
参考答案:A
本题解析:
本题难度:一般
5、填空题 空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下
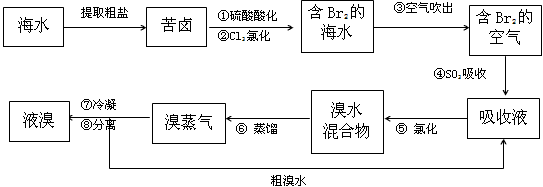
(1)溴在周期表中位于______周期,______族。
(2)步骤④的离子方程式:______________________________。
(3)已知溴的沸点是58.5℃,步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-90℃。温度过高或过低都不利于生产____________,请解释原因:________________________。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。若在实验室分离上述混合物的分离仪器的名称是____________,分离时液溴从分离器的_________(填“上口”或“下口”)排出。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:________________________________________________。
参考答案:(1)第四;ⅦA
(2)Br2+SO2+2H2O=4H++2Br-+ SO42-
(3)温度过高,大量水蒸气排出,溴气中水增加;温度过低,溴不能完全蒸出,吸收率低
(4)分液漏斗;下口
(5)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高,“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的富集过程
本题解析:
本题难度:一般