微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题:
(1)请写出F的电子式______;在②反应中,当生成2.24L的G(标准状况)时,反应转移的电子数目为______
(2)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出稀溶液中①的离子方程式:______.
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B分别为______.(写化学式)
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂,则反应①的化学方程式为______;
若1.7g?D与O2反应生成气态的产物时放出22.67kJ热量,写出该反应的热化学方程式:______.
参考答案:E为常温下无色无味的液体且在生成物中,所以是水.F为淡黄色粉末,是过氧化钠或硫,但能和水反应,所以是过氧化钠.过氧化钠和水反应的生成物是氧气和氢氧化钠,G为常见的无色气体,所以G是氧气,H是氢氧化钠.
(1)F为过氧化钠,其电子式为
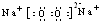
,
设该反应转移电子的物质的量xmol
2Na2O2+2H2O=4NaOH+O2↑? 转移电子数
? 22.4L? 2mol
?2.24L? x
?x=0.2mol,即数目为0.2NA或1.024×1023,
故答案为:
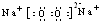
;0.2NA或1.024×1023;
(2)若A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则A是氯气,与碱反应,生成盐酸盐、次氯酸盐和水,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)若C、D是两种均能使澄清的石灰水变浑浊的无色气体,即C、D是二氧化碳和二氧化硫,E为水,所以C、D、E是浓硫酸和碳反应的产物,故答案为:C、浓H2SO4;
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂即氯化钙,所以A和B的反应可以是氯化铵和氢氧化钙生成氨气、氯化钙和水的反应,即2NH4Cl+Ca(OH)2?△?.?CaCl2+2H2O+2NH3↑;
根据热化学方程式的含义,1.7g即0.1mol氨气与O2反应生成气态的产物时放出22.67kJ热量,则4mol氨气与O2反应生成气态的产物时放出906.8KJ的热量,即热化学方程式为:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8KJ/mol,
故答案为:2NH4Cl+Ca(OH)2?△?.?CaCl2+2H2O+2NH3↑;4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8KJ/mol.
本题解析:
本题难度:一般
2、推断题 已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
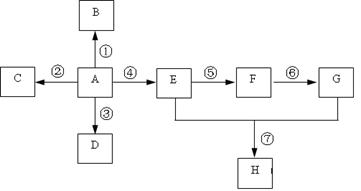
(1)写出下列各物质的官能团的名称:
A ___________;F ___________;G___________。
(2)按要求写出下列各步变化的化学方程式(注明反应条件)
反应①_____________________________________________________;
反应④_____________________________________________________;
反应⑦ _____________________________________________________。
(3)写出下列反应类型:
反应① ___________,反应②___________,反应④___________,反应⑦___________。
参考答案:(1)碳碳双键;醛基;羧基。(各1分)
(2) (2分);
(2分);
CH2=CH2+H2O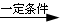 CH3CH2OH(2分);
CH3CH2OH(2分);
CH3CH2OH+CH3COOH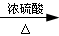 CH3CH2OOCC H3+H2O(2分)。
CH3CH2OOCC H3+H2O(2分)。
(3) 加聚反应 ,氧化反应,加成反应,酯化反应(或 取代反应)。(各1分)
本题解析:A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30,即A为CH2=CH2,B为聚乙烯;C为二氧化碳;D为乙烷;E为乙醇;F为乙醛;G为乙酸,H为乙酸乙酯。所以(1)AFG含有的官能团分别为:碳碳双键;醛基;羧基;(2)反应①为乙烯加聚成聚乙烯,其化学反应方程式为: ;反应④为乙烯与水加成为乙醇,其化学反应方程式为:CH2=CH2+H2O
;反应④为乙烯与水加成为乙醇,其化学反应方程式为:CH2=CH2+H2O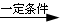 CH3CH2OH;反应⑦为乙酸乙醇在浓硫酸的催化加热条件下生成乙酸乙酯,其化学反应方程式为:CH3CH2OH+CH3COOH
CH3CH2OH;反应⑦为乙酸乙醇在浓硫酸的催化加热条件下生成乙酸乙酯,其化学反应方程式为:CH3CH2OH+CH3COOH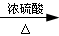 CH3CH2OOCC H3+H2O;(3)反应①为乙烯加聚成聚乙烯,属于加聚反应;反应②为乙烯被氧化为二氧化碳,属于氧化反应;反应④为乙烯与水加成为乙醇,属于加成反应;反应⑦为乙酸乙醇在浓硫酸的催化加热条件下生成乙酸乙酯,属于酯化反应,或者是取代反应。
CH3CH2OOCC H3+H2O;(3)反应①为乙烯加聚成聚乙烯,属于加聚反应;反应②为乙烯被氧化为二氧化碳,属于氧化反应;反应④为乙烯与水加成为乙醇,属于加成反应;反应⑦为乙酸乙醇在浓硫酸的催化加热条件下生成乙酸乙酯,属于酯化反应,或者是取代反应。
点评:本题考查了有机物之间的转化,涉及考查了官能团的相关知识,有机反应,有机反应的类型,本题关键是要推断出A?为乙烯,本题难度不大。
本题难度:一般
3、选择题 已知A为中学化学中的常见金属,X、Y为常见非金属。X、E、F、G、J常温下为气体,C为无色液体,B是一种盐,受热易分解。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图(部分反应的条件、生成物被略去):

请填写下列空白:
⑴金属A为?;操作a是将D溶液在HCl气流中蒸干,原因是?
⑵反应②的化学方程为:?;
反应⑤的化学方程:?。
⑶原电池反应①中,正极反应式为:?。
参考答案:⑴镁(Mg)?防止金属离子(Mg2+)水解?
⑵ 4NH3+5O2 4NO+6H2O? C+4HNO3(浓)
4NO+6H2O? C+4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
⑶ 2NH4++2e-=2NH3↑+H2↑
本题解析:本题的突破口有两个:一是E→F→G→H,属于常温下气体E的连续氧化得到气体G,在中学阶段可推出E为NH3、F为NO、G为NO2,则H为HNO3;二是C为无色液体,由气体X(X由原电池反应得到,可能是H2)和氧气反应得到,故C应是H2O,X是H2,则Y是非金属C。再由反应⑤可知J是CO2,则进一步推出A为Mg。其余物质可以依次推出。
本题难度:一般
4、填空题 (本题共14分)
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置?,
(2)写出检验D溶液中阳离子的方法?。
(3)写出反应④的离子方程式?。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式:?;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH?7
(填“>”、“<”或“=”),用离子方程式表示其原因:?;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是?。
参考答案:
小题1:第四周期、第Ⅷ族
小题2:取少许D溶液于试管中,滴加KSCN溶液,溶液变红色,证明D溶液中含有Fe3+
小题3:2Al+2OH-+2H2O====2AlO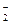 +3H2↑
+3H2↑
小题4:3Fe(s)+2O2(g)======Fe3O4(s)?△H=-6QkJ/mol
小题5:?<?NH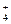 +H2O
+H2O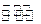 NH3·H2O+H+?
NH3·H2O+H+?
c(NH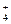 )>c(SO
)>c(SO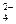 )>c(H+)>c(OH-)? (2分,不是从大到小顺序的不得分)
)>c(H+)>c(OH-)? (2分,不是从大到小顺序的不得分)
本题解析:略
本题难度:简单
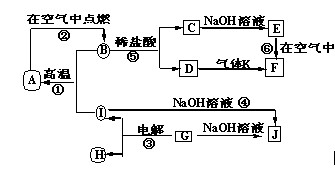
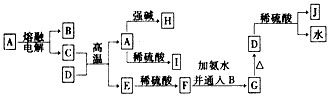
5、推断题 下列各物质的转化关系如下图所示,其中A是一种高熔点固体,D是一种红棕色固体。
回答下列问题:
(1)C的化学式为___________;J的化学式为____________。
(2)写出A与NaOH溶液反应生成H的离子方程式:______________________。
(3)写出C和D反应的化学方程式:________________________。
(4)从F到G的实验现象为_________________________。
参考答案:(1)A1;Fe2(SO4)3
(2)Al2O3+2OH- = 2A1O2- +H2O
(3)
(4)先产生白色沉淀,很快白色沉淀变成灰绿色,最终变成红褐色
本题解析:
本题难度:一般